涉及人的臨床研究倫理審查委員會
涉及人的臨床研究倫理審查委員會
建設指南
(2023版)
國家衛(wèi)生健康委醫(yī)學倫理專家委員會辦公室
中國醫(yī)院協(xié)會
2023年6月
目錄
第一部分序言1
第二部分建設指南3
第一章倫理審查委員會宗旨與原則 3
第二章倫理審查委員會組織與管理 5
第三章倫理審查委員會職責和權力 10
第四章倫理審查委員會審查內容及要求 11
第五章倫理審查委員會審查方式和類別 19
第六章受理倫理審查所需材料及準備工作 23
第七章組織審查會議 27
第八章利益沖突管理政策 33
第九章術語表 33
第三部分附則4 1
附則一藥物/醫(yī)療器械臨床試驗倫理審查 41
附則二遺傳學和生殖醫(yī)學研究倫理審查 45
附則三精神醫(yī)學臨床研究倫理審查 50
附則四公共衛(wèi)生領域臨床研究倫理審查 53
附則五 中醫(yī)藥臨床研究倫理審查 60
附則六干細胞臨床研究倫理審查 63
附則七人體器官移植臨床應用與研究倫理審查 67
附則八 突發(fā)重大疫情風險時相關醫(yī)學研究倫理審查 72
附則九不同層級、不同機構的倫理委員會溝通要點 81
第一部分序言
以人作為受試者的醫(yī)學研究旨在獲得可以被普遍化的醫(yī)學知識、 臨床診治方法和醫(yī)學治療手段,更好地滿足公眾的醫(yī)療健康需求。臨床研究尤其應重視解決尚未能滿足的醫(yī)療和公眾健康需求的健康問題,其社會使命是預防及減輕人類因疾病和損傷造成的痛苦。以人作為受試者的臨床研究是醫(yī)學發(fā)展所必須的,不僅是倫理上允許的也是倫理上所要求的。只有當受試者得到充分的尊重和保護,臨床研究才能在倫理學上得到論證,這也有利于醫(yī)學和科學的健康發(fā)展。
在科學性上不可靠的研究設計必然是不符合倫理的,因為它使研究受試者暴露于參加研究的風險之中,而不能獲得可靠的科學知識。因此,研究設計必須符合科學共同體普遍接受的科學原則,有科學證據支持,研究結果才是可靠的。受試者參加臨床研究是相信這些研究已經通過了基礎性研究的科學驗證,參與臨床研究潛在的受益與可能遭受的風險是在合理范圍內的,醫(yī)生在未來做出重大醫(yī)療決策時相信他們所依據的這些研究證據是縝密而且公正客觀的。
臨床研究人員對受試者保護負有首要責任。研究應該由勝任的研究人員以負責任的方式進行,絕不能將受試者,特別是健康上處于脆弱狀況的受試患者置于驗證醫(yī)學知識的危險之中,不應該為了獲得更多的臨床科學知識、為了未來大多數患者的健康利益而置當前研究中
受試者的安危于不顧。
在研究中應向受試者提供有關臨床研究的現狀以及可能存在風險的確切信息,并獲得有完全決策能力受試者的有效知情同意。對于缺乏完全自我決策能力的受試者,應該獲得其法定監(jiān)護人的同意。
倫理審查委員會和倫理審查的主要職責是對滿足科學價值和社會價值的研究項中受試者的保護。
所有臨床研究項目在開展之前須經倫理審查委員會對其科學價值和倫理學上可辯護性進行審查,獲得倫理審查委員會批準后方可實施。倫理審查委員會在臨床研究實施過程中根據需要對項目作進一步的跟蹤復審,監(jiān)督研究過程。
為進一步規(guī)范臨床研究,不斷加強倫理審查委員會的制度建設和能力建設,在國家衛(wèi)生健康委員會領導和指導下,國家衛(wèi)生健康委醫(yī)學倫理專家委員會和中國醫(yī)院協(xié)會牽頭建立我國的臨床研究倫理審查委員會建設和評估指南,通過第三方行業(yè)組織推動行業(yè)規(guī)范發(fā)展。這些指南與原國家衛(wèi)生與計劃生育委員會頒布的《涉及人的生物醫(yī)學研究倫理審查辦法》、原國家食品藥品監(jiān)督管理局頒布的《藥物臨床試驗倫理審查工作指導原則》,國家中醫(yī)藥管理局頒布的《中醫(yī)藥臨床研究倫理審查管理規(guī)范》以及世界醫(yī)學會制定的《赫爾辛基宣言》和國際醫(yī)學科學理事會制定的《涉及人的健康相關研究國際倫理指南》(International Ethical Guidelines for Health-related ResearchInvolvingHumans) 等國際國內通用倫理準則保持高度的一致性,具有更強的可操作性。
第二部分建設指南
第一章倫理審查委員會宗旨與原則
一、倫理審查委員會宗旨
倫理審查委員會對所有以人作為受試者的臨床醫(yī)學和健康研究項目進行事先的審查、提出修改要求、是否批準,對進行中項目的跟蹤復審,對研究在科學、倫理和規(guī)范方面是否符合國際和國內相關規(guī)范和指南發(fā)揮監(jiān)督作用。其宗旨是保護研究受試者的權利和福祉。
二、倫理審查委員會審查原則
( 一) 尊重和保障預期的研究受試者是否同意參加研究的自主決 定權,嚴格履行知情同意程序,防止使用欺騙、不當利誘、脅迫(包 括變相脅迫) 等不當手段招募研究受試者,允許研究受試者在研究的任何階段撤消對參加研究的同意而不會受到不公正對待。
(二) 對研究受試者的安全、健康和權益的考慮必須重于對科學知識獲得和社會整體受益的考慮,力求使研究受試者最大程度受益和盡可能避免大于最低風險。
(三) 免除研究受試者在受試過程中因受益而承擔的經濟負擔。尊重和保護研究受試者的隱私信息,如實告知涉及研究受試者隱私信息的保存和使用情況(包括未來可能的使用) 及保密措施,未經有效
授權不得將涉及研究受試者隱私和敏感的個人信息向無關第三方或者媒體泄露。
(四) 確保研究受試者受到與參與研究直接相關的損傷時得到及時免費的治療和相應的補償或賠償。
(五) 對于喪失或者缺乏維護自身權益能力的研究受試者、患嚴重疾病無有效治療方法的絕望患者,以及社會經濟地位很低和文化程度很低者等脆弱人群,應當予以特別保護。
(六) 開展生物醫(yī)學臨床研究應當通過倫理審查。國家法律法規(guī)和有關規(guī)定明令禁止的,存在重大倫理問題的,未經臨床前動物實驗研究證明安全性、有效性的生物醫(yī)學新技術,不得開展臨床研究。
三、監(jiān)管責任
( 一) 醫(yī)療機構對在本機構開展的臨床研究負有責任。醫(yī)療機構 也可以委托授權機構內一個部門行使監(jiān)管職責,并受理對研究中有關研究受試者保護問題的投訴。
(二)醫(yī)療機構或授權監(jiān)管部門對倫理審查委員會開展工作負有組織管理以及提供支持性的工作保障的責任,包括提供必要的人力資源、工作環(huán)境、設施設備和工作時間以及經費的支持,并負責對委員會委員科研倫理培訓提供機會和經費的支持。倫理審查委員會委員的工作時間和精力付出應當得到合理的報酬。所有相關監(jiān)管措施應有書面?zhèn)浒赣涗洝?/span>
(三) 醫(yī)療機構或授權的監(jiān)管部門應避免對審查工作的行政干預,確保倫理審查工作和道德判斷上的獨立性。
第二章倫理審查委員會組織與管理
一、倫理審查委員會組成
( 一) 倫理審查委員會應由多學科專業(yè)背景的委員組成,可以包 括醫(yī)藥領域和研究方法學、倫理學、法學等領域的專家學者。應該有一名不屬于本機構且與項目研究人員并無密切關系的委員(同一委員 可同時符合這兩項要求)。人數不少于 7 名。必要時可聘請?zhí)厥忸I域專家作為獨立顧問。對獨立顧問的資質、聘請程序及工作職責應有明確制度規(guī)定,對獨立顧問的聘請過程記錄備案(放到文件記錄內容)。
(二)醫(yī)療機構應當設立直接隸屬于醫(yī)療機構、獨立行政建制的倫理審查委員會辦公室,確保倫理委員會能夠獨立開展倫理審查工作。辦公室應根據審查工作實際需要配備能夠勝任工作的專(兼) 職秘書 和工作人員。
(三) 倫理審查委員會應能夠依據法規(guī)、倫理準則和相關規(guī)定,獨立地審查和批準在科學價值、社會價值及研究受試者保護方面符合指南的研究項目。
(四) 倫理審查委員會應對倫理審查委員會人員名單、聯系信息、人員任命的變更等予以及時更新,并提交至機構或者授權監(jiān)管倫理審查委員會的部門備案,并按照規(guī)定完成國家衛(wèi)健委和國家藥品監(jiān)督管理局(NMPA) 所要求的備案程序。
二、委員資格
所有委員在開始工作之前,應當經過科研倫理的基本專業(yè)培訓并
獲得省級或以上級別的科研倫理培訓證書。參與藥物臨床試驗倫理審查的委員應按照要求獲得國家藥監(jiān)局認可的 GCP 培訓證書。委員應具有較強的科研倫理意識和倫理審查能力,應每 2 年至少參加一次省級以上(含省級) 科研倫理專題培訓并獲得培訓證書,以及參加科研倫 理繼續(xù)教育培訓(包括線上或線下) 并獲得學分,其中 I 類學分應不少于 5 分,以確保倫理審查能力得到不斷提高。
三、委員任命程序和任期
( 一) 倫理審查委員會主任委員、副主任委員和其他委員人選由 醫(yī)療機構負責提議推薦。倫理審查委員會主任委員、副主任委員人員應當在醫(yī)療機構內具有較高的威望與聲譽,其推舉也可由倫理審查委員會委員協(xié)商決定。醫(yī)療衛(wèi)生機構的法人代表或科研主管部門的負責人不擔任主任委員/副主任委員。所有委員產生程序以文件形式備案,該備案文件包括推薦職務和任期,以及所有委員的個人簡歷。
(二) 委員每屆任期不超過 5 年,可連任,最長任期無限制。委 員離任時,倫理審查委員會秘書應及時通知機構或授權的主管部門。委員的換屆工作應按照程序進行并記錄在案。
(三) 如倫理審查委員會需要解聘尚未到期的受聘委員,必須對其未能履職的原因予以說明(如,經常缺席會議、行為不當,或有尚 未解決的利益沖突問題等)。倫理審查委員會應做出免職決議,并向主管部門提出提前終止委員任期的申請,并需要獲得批準。如果委員接受倫理審查委員會的免職決議,由倫理審查委員會主管部門向其發(fā)出書面免職通知。
四、委員職責
(一)主任委員職責1.主持會議
根據國際國內科研倫理準則和管理要求,主持審查所有以人為受試者的研究項目,敦促每個委員都應有機會參與倫理審查的決議過程;
2.了解并確定處理利益沖突
詢查委員是否與試驗項目存在利益沖突。如果存在利益沖突,則需要確定(1) 在委員會內部公開利益沖突;或(2) 要求該委員回避對相關研究方案的審查,并且不參與投票。
3.確保研究者以及主審委員向倫理審查委員會所提交的對試驗方案的審查報告遵循倫理審查委員會的審查指南,包括在細節(jié)上符合國際和國內通用的科研倫理準則。
4.主任委員可根據委員專業(yè)背景、審查能力以及待審查項目專業(yè)領域,為項目指定 1 個或若干委員在會議審查之前先行重點審查某些研究方案(主審制),然后將審查報告提交倫理審查委員會進行會議審查。
5.確保倫理審查委員會對所有試驗方案進行初始會議審查和復審。
6.向委員、科研人員和其他相關人員提供對涉及人的受試者的臨床研究的工作指導意見和專業(yè)指導意見,并與全體委員協(xié)作,以高水準行使倫理審查委員會的職能。
7.及時通告國際國內新頒布和制定的相關政策和倫理準則,保證
委員有學習提高審查能力的機會,以便加強對倫理準則和規(guī)范的理解。
(二)副主任委員職責
當主任委員缺席時,行使主任委員既定的所有職責。
(三)委員職責
1.對會議的議事項目進行充分的準備,例行參加審查會議,準確審評會議的各項內容,對研究項目進行審核并做出審查決議。
2.倫理審查委員會委員應當簽署保密協(xié)議,承諾對承擔的倫理審查工作履行保密義務,對所受理的研究項目方案、受試者信息以及委員審查意見等保密。
3.接受相關包括科研倫理繼續(xù)教育和培訓,不斷提高審查能力。
五、委員會議出席率要求
倫理審查委員會應制定關于委員會議出席率的相關要求。
六、培訓和繼續(xù)教育要求
( 一) 倫理審查委員會應建立培訓機制。所有委員(包括主任委員,副主任委員) 及專(兼) 職秘書和辦公室工作人員在行使其職責 前至少接受過一期相關法律法規(guī)、部門規(guī)章、倫理審查知識以及倫理審查委員會指南操作規(guī)程的培訓并獲得省級(含省級)以上培訓證書后方可任職。培訓的記錄保存在倫理審查委員會辦公室。
(二) 委員定期接受相關的繼續(xù)教育并保存培訓記錄。對于倫理審查委員會制度、指南及指南操作規(guī)程的更新,全體委員須進行培訓。倫理審查委員會負責定期對醫(yī)療衛(wèi)生機構內相關人員進行倫理知識的培訓。
(三) 要求倫理審查委員會主任委員、副主任委員和委員參加多種繼續(xù)教育培訓(包括線上或線下),包括相關倫理課程、倫理審查研討會、倫理報告和經驗分享等學術活動以及較高質量的其他學術活動,其中每兩年應該獲得 I 類學分不少于 5 分。
七、倫理審查委員會管理
( 一) 倫理審查委員會應按照檔案管理規(guī)范對檔案文件的保存、管理、查閱和復印做出相關規(guī)定,以保證文件檔案的安全和保密性。倫理審查文件的保存期限應符合不同研究類型的規(guī)定。
(二)醫(yī)療機構需要為倫理委員會提供獨立、充足的檔案保存空間,保證檔案的安全性和保密性。
(三) 為不斷完善倫理審查質量,完善對倫理審查委員會管理和審查制度,倫理審查委員會應對工作質量的檢查和評估中發(fā)現的問題及時改進,并保存相關記錄。
(四) 倫理審查委員會還應建立相應的制度文件和指南操作規(guī)程,可包括但不限于:
1.倫理審查申請指南;
2.倫理審查的保密措施;3.獨立顧問的選聘制度;
4.利益沖突的管理;5.培訓制度;
6.經費管理制度;
7.受試者咨詢和投訴的管理制度。
第三章倫理審查委員會職責和權力
一、做出審查決定
倫理審查委員會應對審查的研究項目做出批準、不批準、修改后批準、修改后再審、暫停或者終止研究的決定。
為滿足受試者保護的倫理要求,委員會行使批準或否決某個研究項目職責和權力,有權要求修改研究項目。因研究項目進行中發(fā)生意外傷害或違規(guī)行為,有權要求暫停或者終止某個已經批準的研究項目。對方案及知情同意書的修正案進行審查,對嚴重不良事件和違背方案等事件進行審查。
二、知情同意要求
有權對知情同意征詢過程提出要求。
三、跟蹤審查要求
根據研究風險發(fā)生的可能性和風險程度,有權要求對已經批準的研究項目進行定期跟蹤復審。
四、其他
按照國家有關分級管理的規(guī)定,完成對不同風險級別的生物醫(yī)學新技術臨床研究項目的審批,確保在本機構倫理審查委員會備案和/或審查。
第四章倫理審查委員會審查內容及要求
一、審查內容
對于臨床研究項目,倫理審查主要包括以下內容:1.研究者的資格、經驗是否符合臨床研究的要求;2.研究方案是否符合科學性和倫理原則的要求;
3.受試者可能遭受的風險程度與研究預期的受益相比是否合理;
4.在獲取知情同意過程中,向受試者或其法定監(jiān)護人提供的有關信息資料是否完整通俗易懂,獲得知情同意的方法是否適當;
5.對受試者的信息和資料是否采取了保密措施;6.受試者入選和排除的指南是否合適和公平;
7.是否向受試者明確告知他們應該享有的權利,包括在研究過程中他們可以隨時退出研究而無須理由,且不因此而受到不公平對待的權利;
8.受試者是否因參加研究而獲得合理補償,如因參加研究而受到損害甚至死亡時,給予的治療以及賠償措施是否合適;
9.研究人員中是否有專人負責處理與知情同意獲得過程和受試者安全相關的問題;
10.對受試者在研究中可能承受的風險是否采取最小化的措施;
11.研究人員與受試者之間是否存在可能會影響研究人員專業(yè)判斷的利益沖突。
二、審查要求
(一)研究的科學價值
醫(yī)療機構對擬議的臨床研究設計的科學性已經進行了充分的專業(yè)評審,確認該研究設計在科學上合理,并可能產生有價值的科學信息。科學性的評審意見應在倫理審查委員會的文檔中備案。
(二)研究的社會價值
1.為了滿足倫理學上的要求,所有臨床研究,包括對臨床病例信息、臨床診斷醫(yī)療剩余的人體組織或樣本數據信息的研究都必須具有社會價值,包括臨床研究擬產生科學信息的質量,以及與重大臨床問題的相關性:是否有助于產生新的臨床干預方法或有助于對臨床干預的評價、有助于促進個人或公共健康等。
2.評價研究社會價值的關鍵要素是臨床研究是否產生有價值的,且無法用其他方法獲得的科學信息。例如,研究的目的只是為了增加醫(yī)生開具與研究相關的處方,則屬于偽裝成科學研究的營銷行為,不能滿足臨床研究社會價值的要求。
3.國際合作研究的目的應當著眼于解決受試人群需要優(yōu)先考慮的醫(yī)療健康問題,關注研究成果所產生的干預措施是否能使本國本地區(qū)人群獲益,以及研究成果的可及性問題。
(三)受試者保護
1.科學價值和社會價值是開展研究的根本理由, 但研究人員、研究申辦者、倫理審查委員會都有道德義務確保所有研究受試者的權利得到尊重和保護。
2.研究的科學和社會價值不能成為使研究受試者受到不公正對待的倫理辯護理由。任何情況下,醫(yī)學科學知識增長的重要性和未來患者的健康利益,都不能超越當前受試者的安全和健康福祉。
(四)受試者招募
1.受試者的招募應當是出于科學原因,而不是因其社會、經濟地位,或絕望中患者所處的健康脆弱地位易于招募。
2.研究受試人群應盡可能包括能夠反映出年齡、性別與民族多樣性的不同群體,以便研究成果能被普遍應用于所有相關人群。
3.將脆弱人群排除在受試者之外,曾被視為最便捷的對他們的保護方式,但這樣的保護方式使脆弱人群無法享用研究成果,影響這些群體疾病的診斷,預防和治療,因此導致對他們的不公正。應當鼓勵脆弱受試者參與臨床研究以糾正這些不公正。
4.當部分或全部被招募的受試者為易受不當影響的脆弱人群(如 兒童、智力障礙和精神障礙者,或者絕望中的患者等) 時,研究方案中需包括額外附加的保護措施以維護這些脆弱受試者的權益。
5.倫理審查委員會需要對受試者招募廣告和招募信函進行審查。在研究進程中,倫理審查委員會亦可要求對招募廣告和招募信函加以必要的修訂。
6.作為通用的倫理原則,不應使受試患者承擔驗證臨床研究的安全性及療效所產生的費用。選擇資助臨床醫(yī)學發(fā)展的機構,應該承擔驗證安全性及療效所產生的所有費用。
(五)知情同意
征得受試者的知情同意是研究開展的必要條件,但不是充分條件,保護受試者免受傷害是研究者的責任。
1.征得受試者書面知情同意
(1) 除關于知情同意豁免條款外,倫理審查委員會要求在臨床研 究開展之前須征得預期受試者或其法定監(jiān)護人的知情同意,并在倫理審查委員會備案。
(2) 知情同意書應以受試者或其法定監(jiān)護人能夠理解的方式和通 俗的語言表達,知情同意是在受試者或/和其法定監(jiān)護人未受到不當影響并經充分考慮的情況下征得的。
(3) 不允許在知情同意書中使用任何可能使受試者或其法定監(jiān)護 人被迫放棄,或傾向于放棄任何合法權利的理由,亦不允許使用任何可使研究者、申辦者、研究機構或相關代理機構免責(或暗示免責)的語言。
(4) 知情同意必須由臨床研究負責人或者其指定的該研究項目的 研究人員獲取,由受試者本人或其法定監(jiān)護人簽字并標明日期。
(5) 在代理同意的臨床研究中,須嚴格保護受試者,努力避免由 于增加非治療程序(出于研究目的) 帶來的風險超過最低風險。
(6) 在知情同意書中,研究者應告知受試者向其提供研究結果的 方式。當無法向受試者提供研究結果時,也應在知情同意書中向受試者說明。
(7) 倫理審查委員會批準的知情同意書被認為是唯一正式的同意 文件,在研究中不允許使用任何與此版本不同的知情同意文件。
(8)已經獲得倫理審查委員會批準版本的知情同意文件保存在倫理審查委員會辦公室。
2.征得受試者口頭知情同意
倫理審查委員會在下列情況下可以允許征得受試者口頭知情同意:
(1) 該臨床研究對受試者可能造成的風險不超過最低限度。
(2) 受試者為文盲或盲人時,可以將知情同意書的內容向受試者 或法定監(jiān)護人口頭提交,一名與受試者和研究者均無利益關系的任何成年人可以作為證人簽字證明受試者的同意。也可以留有音像資料作為證據。
(3) 受試者與臨床研究的唯一聯系是將要存檔的知情同意文件, 并且受試者參加研究的首要風險是由于敏感信息和隱私泄露可能導致的風險或傷害(包括但不限于涉及暴力、強奸、艾滋病患者的調查和 訪談,涉及性工作者或吸毒的社會和行為學研究等),受試者可能擔憂簽署知情同意書會對受試者的隱私保護構成威脅,在此情況下倫理審查委員會經過討論和評價,可以批準征得口頭同意,但應留有聲音文件等證明文件作為同意的證據。倫理審查委員會仍可要求研究人員向受試者提供有關知情同意書的內容。
3.事后知情同意
某些特殊的心理和行為社會學研究,如果要求征得受試者的知情同意,研究將無法進行。倫理審查委員會可批準事后(研究結束后)知情同意。倫理審查委員會應該對研究的風險加以評價,確認研究的
風險不大于最低風險,并且事后知情同意可以被受試者理解和接受。4.豁免再次征得知情同意
符合下列必要充分條件時,倫理審查委員會可以批準豁免再次征得受試者的知情同意:
(1) 臨床研究需要對知情同意書進行微小修改,否則該研究實質 上將無法完成。
(2) 受試者可能遭受的風險不超過最低限度。
(3) 修改知情同意的內容和征得程序,以及豁免再次征得受試者 的知情同意并不會對受試者的權益產生負面影響。
(4) 豁免再次征得知情同意,不意味著免除倫理審查委員會的審 查。
5.豁免知情同意
在滿足下列必要充分條件時,倫理審查委員會可以批準豁免知情同意:
(1) 受試者可能遭受的風險不超過最低限度。
(2) 豁免征得受試者的知情同意并不會對受試者的權益產生負面 影響。
(3) 利用可識別身份信息的人體材料或者數據進行研究,已無法 找到受試者,且研究項目不涉及個人隱私和商業(yè)利益。
(4) 生物樣本捐獻者已經簽署了知情同意書,同意所捐獻樣本及 相關信息可用于所有醫(yī)學研究。
(5) 豁免征得知情同意,不意味著免除倫理審查委員會的審查。
(六) 對研究可能的風險與獲益的評估
1.如果研究的目的使受試者個人在診斷、治療或預防方面直接獲益,應該通過論證確定研究的風險和獲益與現有的其他干預方法相比,至少可以有同樣的獲益。對這類“能夠獲益的”干預的風險需要與對受試者個人預期的獲益進行權衡和合理性論證。
2.如果研究的目的不是使受試者直接獲益,那么對受試者個人的風險必須與研究預期的社會受益(即可以獲得被普遍化的醫(yī)學知識) 進行權衡和論證。研究帶來的風險對于可能獲得的知識而言必須是合理的。
3.為了重要的科學價值,允許受試者可能遭受的風險略高于最低風險時,應嚴格將風險限制在一定范圍之內,不可使受試者遭受嚴重的或不可逆的傷害。
4.研究涉及無行為能力或限制行為能力的受試者時,應該對招募此類受試者在科學上和倫理上的合理性進行論證。不能使受試者個人直接獲益的研究,其風險不可大于常規(guī)醫(yī)療的風險。如果允許稍微增加的風險,必須存在極充分的科學或醫(yī)學上的理由和根據,且須獲得倫理審查委員會的批準。
5.在對研究的風險與受益進行評估時,倫理審查委員會僅考察由研究本身所可能引起的風險和受益。
6.研究所獲得的數據信息可能在日后被使用,而日后應用可能涉及的風險不屬于對本研究風險的評估之列。
7.在初始審查和復審時,應評估并記錄受試者的受益是:
(1) 無預期受試者個人的直接獲益,但有可能獲得有關該受試群 體疾病的信息;
(2) 無預期受試者個人的直接獲益,但有可能獲得基于所研究疾 病可能產生的深遠社會效應和科學知識的積累;
(3) 研究包括對受試者個人的直接獲益。
8.在初始審查和復審時,應評估并記錄受試者所面臨的風險程度是:
(1)不超過最低限度的風險;
(2)比最低限度稍微增加的風險或更高的風險。
(七)保護隱私與保密
1.倫理審查委員會需確保研究項目有充分措施以保護受試者隱私并維護受試者個人信息的保密性;
2.當出于受試者健康需要、科學研究和重大公共利益需要,使用受試者個人健康信息時,須經有效授權。
三、批準指南
( 一) 該研究的科學性已經得到充分的學術論證,其社會價值以 及受試者權利得到充分的尊重和保護。倫理審查委員會經過充分的討論,以法定有效票(根據倫理審查委員會章程及國家相關規(guī)定確定) 批準一項研究申請。
(二)申請倫理審查的研究項目,已經按照國家相關規(guī)定獲得相應審批。如適用,包括但不限于人類遺傳辦公室批件、國家藥監(jiān)局臨床試驗批件、放射性或生物安全委員會等機構的批件。
(三)申請倫理審查的研究項目有數據和安全監(jiān)督(DSM) 措施,確保受試者安全。
(四) 對于風險程度不同的生物醫(yī)學新技術臨床研究,符合國家頒布的有關規(guī)定。
第五章倫理審查委員會審查方式和類別
一、倫理審查方式
(一)會議審查
召開倫理審查委員會會議進行審查,包括但不限于對研究方案的初始審查和復審。
(二)簡易程序審查
倫理審查委員會主任委員可指定一個或幾個有相關專業(yè)背景和經驗的委員,對研究方案進行簡易程序的審查。符合簡易審查的條件:
1.已經獲得倫理審查委員會批準并在批件有效期內,對研究方案的微小改動。微小改動是指一種不導致研究風險受益狀況變化的改動;一種不影響研究中受試者的意愿的改動;一種不改變研究設計的科學有效性的改動。微小改動的例子包括(但不限于) 進一步降低風險的 程序、為加強受試者安全性而增加的實驗室測試等。
2. 在多中心臨床研究中,參與單位可通過簡易審查程序認可單一倫理審查的決定。
3.在實施簡易程序審查時,倫理審查委員會主任委員(或者指定 委員) 接收并且審查申請材料。簡易程序可以履行倫理審查委員會所
有職權(除不批準該研究之外)。
4.如果對簡易審查的決定是不予批準,或者認為不符合簡易程序條件的,應將決定書提交倫理審查委員會。
5.簡易程序審查并不意味著審查指南的不同,也不必然意味著審查過程在時間上的縮短(雖然由于審查程序的簡便,審查時間上通常 會更短)。簡易程序只是意味著在程序上免除了會議審查。
6.簡易程序審查結果應該通知倫理審查委員會全體委員。
(三) 緊急情況受試者研究的審查
1.即使是緊急情況下,未經倫理審查委員會事先審查和批準,不允許開展以人作為受試者的臨床研究。
2.當緊急醫(yī)療涉及使用研究中的藥物,設備或者生物制劑時,患者不能被認為是緊急情況下的臨床研究的受試者。這樣的緊急處理是醫(yī)療而不是研究,涉及該醫(yī)療的任何數據也將不會被包含在任何一個前瞻性研究活動的報告中。
3.當緊急醫(yī)療涉及使用研究中的藥物,設備或者生物制劑時,必須滿足我國權威管理部門的相關規(guī)定和要求。
(四)應急審查
疫情爆發(fā)期間開展疫情相關研究的緊迫性對倫理審查委員會的審查工作提出巨大挑戰(zhàn)。倫理審查委員會應當堅持以最高的科學與倫理學標準對研究項目進行獨立且公正的審查,保證倫理審查的質量與時效。相關要求詳見附則八。
二、倫理審查類別
為確保臨床研究項目倫理審查申請符合規(guī)范以及倫理問題得到及時的考慮和處理,倫理審查委員會應進行初始審查和復審程序。
(一)初始審查
初始審查是指研究者在研究開始實施前首次向倫理委員會提交的審查申請。
(二)復審
復審包括再審、修正案審查、跟蹤審查、嚴重不良事件審查、違背方案審查、暫停和/或終止研究審查、結題審查等。
1.倫理審查委員會對已經批準實施的臨床研究根據研究風險程度和發(fā)生的可能性進行一定頻率的跟蹤審查。
2.除對符合簡易程序審查條件的方案進行簡易程序審查外,倫理審查委員會要求對研究方案的初始審查進行會議審查,審查決定有效期最長不超過 12 個月。對于超過一年的臨床研究進行跟蹤審查,直到不再從受試者那里產生新的數據為止。
3.進行跟蹤審查時,須將所有先前批準的或者修改的內容一并整理到試驗方案中。
4.如果研究項目負責人逾期一個月仍未按審查決議規(guī)定向倫理審查委員會遞交跟蹤審查的相關材料,委員會可以終止其試驗的繼續(xù)進行。重啟已被終止的試驗方案需要向審查委員會重新遞交試驗方案申請。
5.倫理審查委員會秘書應為會議審查準備好完整的試驗方案、跟
蹤審查報告以及倫理審查記錄等文檔,以供會議審查時委員查閱。6.對已批準的試驗方案進行修改
如果項目負責人在試驗過程中需要對已獲批準的研究方案進行修改,需要得到倫理審查委員會對修改后方案的批準方可按照修改后的方案實施。除非符合簡易程序審查的要求外,試驗方案的修改需經倫理審查委員會會議審查批準。
7.對終止試驗方案申請的審查
(1)由項目負責人提交的試驗方案終止申請,須經倫理審查委員會會議審查,要確保其受試者的安全和福祉不會因試驗終止而受到危害。
(2) 對違反倫理規(guī)定試驗方案的終止應由倫理審查委員會提出,并經會議審查予以審查。
8.合作項目/多中心合作研究項目的審查
(1) 對國際合作項目的審查需要提供國際牽頭單位倫理審查委員 會審查批準文件,無論資金來源如何。
(2)國內合作研究項目,向各醫(yī)療機構間倫理審查委員會所提交的試驗方案一致,以及同意文件應基本一致。倫理審查委員會承認知情同意書在不同機構可以有細微差別。
(3) 多中心研究項目中,如果醫(yī)療機構倫理審查委員會認為對項 目的核查是必要的,醫(yī)療機構的倫理審查委員會可以獨立做出審查決議,或可以對研究項目提出修改意見。也可以參考其他機構的倫理審查委員會做出的審查意見及決定或接受研究項目的單一審查決定。
9.嚴重不良事件或非預期事件審查
(1) 項目負責人有責任及時向倫理審查委員會報告研究過程中發(fā) 生的嚴重不良事件。
(2) 倫理審查委員會需要對事件是否為非預期事件、其嚴重程度、以及對研究造成不利影響的相關程度做出判斷,并將其評估記錄備案。
(3) 對非預期嚴重不良反應,倫理審查委員會可以要求修改、暫 停或是終止臨床研究。并應及時將決定與研究項目負責人、機構負責人、研究管理部門負責人溝通,并將其記錄備案。
(4) 研究實施中發(fā)生的其他事件,研究項目負責人須在跟蹤審查 中向倫理審查委員會遞交報告。
第六章受理倫理審查所需材料及準備工作
一、研究項目負責人的責任
( 一) 研究項目負責人對研究設計、實施和監(jiān)督負責。在涉及人 的臨床研究開始之前,項目負責人有責任確保已經征得受試者的知情同意,并確保同意是充分了解臨床研究方案之后的自愿的同意。
(二) 項目負責人需要向倫理審查委員會遞交臨床研究方案和知情同意書(包括知情過程) 及其他相關的文件。
二、研究項目負責人需要向倫理審查委員會遞交的文件
(一) 初始審查申請遞交的文件,包括但不限于1.完整的研究方案
臨床研究方案的內容包括但不限于標有日期、版本號和頁碼的完
整研究方案,包括項目簡介、研究目標、研究設計和方法、納入和排除指南、受試者的保護措施(研究受試者選擇的理由,招募計劃及程 序,對征得知情同意過程的說明;以及對受試者隱私保護和保守受試者機密信息的措施;對研究受試者合理補償的計劃;不良事件報告的計劃)。如適用,還應該包括數據和安全監(jiān)測計劃、使用和貯存生物樣本的計劃等內容。
2.知情同意文件
適當時,倫理審查委員會可要求提供知情同意書的翻譯文件(如 受試者為少數民族時)。知情同意文件內容包括:
(1) 研究目的、研究背景和產品介紹,以及受試者參與研究的預 計持續(xù)的時間;
(2) 對研究過程和招募受試者大致數量的說明;
(3) 對可預見的風險及受試者可能遭受的不適或不便的說明,并 估計其發(fā)生的可能性。適當的話,說明采取的預防、減輕和處理這些風險或不適的措施;
(4) 對受試者從研究中預期可能的任何獲益的說明;
(5) 如果可能,對受試者可能有好處的、適當的替代程序或療程;
(6) 對受試者隱私和機密信息的保護措施,對誰可能接觸或獲得 研究記錄的說明;
(7)如果研究涉及可能超過最低風險限度,對于一旦發(fā)生的傷害,受試者可獲得醫(yī)療以及補償和/或賠償的說明;
(8)回答受試者有關研究涉及的科學問題、研究受試者的權利問
題的聯系人及其聯系方式;
(9) 說明參與研究是自愿的,受試者拒絕參與研究或在任何時候 退出對研究的參與,不會受到不公正對待,不會影響受試者與臨床醫(yī)生的關系和正常醫(yī)療,也不會因此而喪失任何應得的健康受益;
(10) 適當時,倫理審查委員會可以要求研究者對受試者提供下列額外的信息:
①治療或研究程序可能對受試者(或對胚胎或嬰兒,如果受試者 是孕婦或可能懷孕的婦女) 有風險,而風險是目前還無法預見的。
②研究者可以未經受試者同意而可能終止預期受試者參與研究或者終止該研究。
③研究過程中新的重大發(fā)現,可能關系到研究受試者繼續(xù)參與的意愿,新的發(fā)現信息將被提供給研究受試者。
④關于研究方案中研究者是否存在潛在利益沖突的申明,以及對潛在利益沖突的說明和解釋。
3. 項目科學性審查通過文件
項目負責人所在醫(yī)療機構研究項目管理部門對擬申請倫理審查研究項目的科學性審查通過的文件;
4.研究者手冊(如有)
5.國家相關規(guī)定所要求的其他文件
(二) 跟蹤審查需要向倫理審查委員會提交的文件1.跟蹤審查申請;
2.跟蹤審查的摘要報告,其內容可以包括:
(1) 簡要說明研究的進展和發(fā)現;
(2)自前一次審查時研究方案所作任何改動的摘要;
(3) 增加受試者的數目,受試者退出研究的摘要;
(4) 不良事件和涉及到任何意料之外的對受試者或其他人的風險 的摘要;
(5)自前次研究倫理委員會審查后,對于研究的任何投訴的報告;
(6) 任何有關的多中心臨床試驗的報告;
(7) 任何來自數據和安全監(jiān)督委員會(DSMB)的報告(如適用);
(8) 對任何其他相關信息的文獻研究,尤其是與研究有關的風險 信息的文獻研究;
(9) 增加任何額外的知情同意內容要求;
(10) 研究繼續(xù)開展的理由。
(三) 修改研究方案時需要向倫理審查委員會提交的文件
1.對任何修改研究方案的說明;
2.修改研究方案給研究帶來任何影響的說明,關于受試者可能承受的風險和獲益的說明;
3.增加額外知情同意的要求。
(四) 結題時需要向倫理審查委員會提交的文件
研究項目負責人向倫理審查委員會提交項目結題報告。
(五) 終止研究時需要向倫理審查委員會提交的文件
研究項目負責人向倫理審查委員會提出終止試驗方案的申請時,應遞交:
1.一份完整的終止研究申請;2.終止原因的簡單說明;
3.終止研究對已經接受干預治療的受試者的影響;4.對目前仍在研究隨訪中的受試者的后續(xù)安排;
5.項目在接受審查時期完成的出版物清單。
第七章組織審查會議
一、會議有效人數
1.會議有效人數是到會參與審查的委員應達到全體委員人數的半數以上且包括醫(yī)藥專業(yè)、非醫(yī)藥專業(yè),獨立于研究/試驗單位之外的人員和不同性別的人員,會議方為有效。
2.通過視頻參加會議的委員,如果在會議之前已經接收到所有適當的材料,并且積極、公正地參與到討論中,這些委員被算入有效委員人數并允許參與投票。
3.有效人數中至少應包含一名資深有專業(yè)背景的臨床醫(yī)生委員。
二、會議表決
1.每一位參與審查的委員都應投票;
2.會議以全體委員人數的 1/2以上(有特殊規(guī)定者例外)的意見做出對審查方案的決議;
3. 特邀獨立顧問不是正式委員會,不參與投票,但他們的專業(yè)意見對委員會做出最終決定是重要的;
4.不允許代理投票;
5.存在實質性利益沖突的委員不參加投票。
三、會議管理
1.會議時間和日程安排
倫理審查委員會需要定期安排審查會議。日程由倫理審查委員會秘書處負責安排,并及時通知臨床研究申請者和審查委員會委員。
2.受理審查申請需要的文件
在會議前至少25 個工作日,研究項目負責人需要向倫理審查委員會提交供審查的材料副本以及電子文本材料。
(1) 初始審查需要遞交的材料:
①倫理審查申請表
②完整詳細的研究方案及支持性文件
③知情同意的文件(申請豁免者除外)
④補充材料(如適用)
(2) 長期項目的跟蹤審查需遞交一份簡要的研究進度報告。
3.文件的分發(fā)
供審核的文件由委員會秘書處準備、整理和分發(fā)。會議之前至少 5個工作日內,每個委員應該收到會議文件,包括通過視頻參加審查會議的委員應該收到電子文本文件。會前分發(fā)文件包括:
(1) 會議日程(包括時間、地點、審查項目列表、審查要求等);
(2) 與本次會議審查項目相關的先前會議紀要;
(3) 提供足夠詳細的研究方案,以幫助委員做出符合相關規(guī)定和
管理要求的決定。
4.會議主持程序
(1) 確定出席會議的委員達到有效人數,宣布會議開始。
(2)需要時對先前會議紀要進行表決。
(3) 在項目負責人離席后,委員會委員討論研究方案(長期方案的年審/短期復審/修正案或者其他方案的審查)。
(4) 做出審查動議,進行表決。
(5) 在審查和討論過所有議程項目后宣布休會。
(6) 倫理審查委員會正式通知項目負責人審查決定。
(7) 參會委員,特邀獨立顧問、委員會工作人員、經允許參加會 議的研究生和訪問進修人員都需要尊重倫理審查委員會審議過程和審查結果的機密性,并在會前簽署有關審查項目、受試者信息和相關事宜的保密協(xié)議。
5.會議決議
(1) 倫理審查委員會應有完整錄音記錄,秘書記錄會議審查內容 并在會后及時整理會議討論摘要和審查決定,形成會議記錄。參加會議的委員審閱無異議后由主任委員(或被授權者) 簽字并備案。
(2) 秘書應根據會議記錄和投票結果形成書面的倫理審查意見和 決定明確的審查批件。批件由主任委員(或被授權者) 簽名并加蓋倫 理審查委員會公章有效。
(3) 倫理審查委員會對提交的研究方案可做出下列決定之一:批 準、修改后批準、修改后再審、不批準、暫停或者終止研究的決定。批準有效期限最長為 12 個月,如果倫理審查委員會認為受試者可能面
臨的風險程度較高,頻率更高的跟蹤審查是必要的。倫理審查委員會可以根據具體研究做出定期跟蹤審查(期限少于 12 個月) 的要求。審查決議和方案批準日期應記錄備案。
①批準
倫理審查委員會可以無條件批準一項初始審查研究方案和跟蹤審查方案。
批準有效期最長不超過 12 個月,批準后研究可以立即開始/或者繼續(xù)進行。
②修改后批準
倫理審查委員會可以有條件地批準一項研究方案。倫理審查委員會提出的修改意見得到項目負責人接受回應,則批準決定生效。
③修改后再審
當倫理審查委員會對審查中研究方案需要更多的實質性信息時,委員會可以做出暫緩審議的決定,直至委員會收到新的信息時,對研究方案重新進行會議審議。
④不批準
倫理審查委員會可以投票反對一項研究方案。不批準的決定和不批準的原因應及時通知項目負責人。不批準的決定只能在會議審查中做出,并應給項目負責人予申辯的機會。
如果項目負責人不同意倫理審查委員會的決議,他應該在申辯過程中同委員會共同解決問題。
⑤暫停或終止研究
倫理審查委員會可以根據研究項目的進展情況做出暫停或終止研究的決定。
除多中心項目的倫理審查外,提交給某個倫理審查委員會審議的方案,既不能同時也不能在該委員會作審查決定之后提交給另一倫理審查委員會審議。
6.會議審查記錄
(1) 法定會議有效人數記錄
①參加倫理審查會議的委員人數不少于全體委員數的 1/2 為會議有效人數。
②應記錄參會委員的名單及其專業(yè)領域。
③應記錄缺席委員名單及其專業(yè)領域。
④應記錄其他到會人員,包括獨立顧問、來訪學者的名單和機構。
(2)投票文件記錄
①投票可以按照下列規(guī)則進行記錄:總計票數=#;批準票數=#;修改后批準票數=#;修改后再審票數=#;不批準票數=#;回避票數=#。
②會議應盡可能通過充分討論和論證達成一致意見。當意見不一致時,不應僅僅以簡單多數的意見加以記錄,應將少數人的意見分別記錄。
③任何關于爭議性意見及倫理問題的討論與解決方案均應記錄在案。
(3)受益/風險評估記錄
倫理審查委員會需要根據臨床研究方案使受試者可能承擔風險程
度和發(fā)生的可能性,以及潛在受益做出評估,并在記錄中說明批準某研究方案的決定是基于對該方案的評估做出的,將記錄存檔。
①成人受試者可參與風險程度的臨床研究為:(a) 不大于最低限 度的風險;(b)比最低限度風險適度增加的風險(由倫理審查委員會對“適度”做出判斷)。
②成人受試者可參與受益等級的臨床研究為:(a) 無預期的受試 者直接獲益,但有可能在受試群體相關疾病的理解方面獲益;(b) 無 預期的受試者直接獲益,但可能有科學知識積累方面的社會受益;(c)該臨床研究包括使受試者個人的直接獲益。
3.兒童受試者可參與的研究:(a) 只有表明研究有可能針對在預 防、減輕影響兒童健康和福祉的那些嚴重問題方面獲得知識時,研究才可獲得批準。(b) 不超過最低限度風險的研究;(c) 適度超過最低限度的風險,但預期會使兒童受試者個人直接獲益的研究;(d) 適度 超過最低風險的限度,且沒有預期使兒童受試者的直接獲益,但可能使兒童受試者群體獲益。
(4)審查決議和其他記錄
會議審查決議記錄,以及對任何有關研究方案和知情同意書改變的細節(jié)均應記錄在審查文件中。
7.倫理審查委員會決定傳達
倫理審查委員會應在審查后 10 個工作日內給出書面的審查意見/批件。
第八章利益沖突管理政策
一、委員選擇
醫(yī)療機構科研管理部門的負責人或臨床研究部門的負責人不應作為倫理審查委員會的主任委員或者副主任委員。
二、回避投票
與研究項目具有顯而易見和實質性利益沖突的委員不能參與倫理審查委員會研究方案的審查。在審查時,主任委員需要詢問是否所有的委員都知曉利益沖突政策和倫理要求,以及與審查中的研究方案是否有需要申明利益沖突的委員,回答將被記錄在案。有明顯和實質性利益沖突的委員應回避參與最終關于該研究方案的討論以及投票。回避事項應記錄備案。
第九章術語表
1.保密性(Confidentiality):防止將涉及所有權的信息或個人身份信息透露給無權知曉者。
2.指南操作規(guī)程(Standard Operating Procedure, SOP):為確 保實施的一致性從而達到特定目的而制定的詳細的書面操作說明。
3.不良事件(Adverse Event):患者或者臨床研究受試者接受某種試驗干預后出現的不良醫(yī)學事件。當事件存在可能的合理性證明時,不良事件與試驗有關。
4.不依從/違背方案(Non-compliance/Violation):指對倫理審
查委員會批準試驗方案的所有偏離,并且這種偏離沒有獲得倫理審查委員會的事先批準,或者不依從/違背人體受試者保護規(guī)定和倫理審查委員會要求的情況。
5.脆弱人群(Vulnerable Population):相對地(或絕對地) 沒有能力維護自身利益的人,通常是指那些能力或自由受到限制而無法給予同意或拒絕同意的人,包括兒童,因為精神障礙而不能給予知情同意的人等。
6.單一審查(Single Review):在多中心臨床研究中,各研究機 構倫理審查委員會之間,通過一定協(xié)作機制,確定一個倫理審查委員會的倫理審查。
7.多中心臨床試驗(Multicentre Trial):遵循同一方案,在多 個試驗中心,分別由多名研究者負責實施完成的臨床試驗。
8.法定到會人數(Quorum):為對某項試驗進行審查和決定而規(guī)定的必須參加會議的倫理審查委員會委員人數和資格要求,即有效會議應出席的委員人數和資格要求。
9.法定監(jiān)護人(Guardian):是指依據法律規(guī)定擔任無民事行為能力人和限制民事行為能力人的監(jiān)護人,履行監(jiān)護職責的人。擔任法定監(jiān)護人應具有監(jiān)護能力。監(jiān)護能力的認定主要根據監(jiān)護人的身體健康狀況、經濟條件,以及與被監(jiān)護人在生活上的聯系狀況等因素確定。根據民法通則的規(guī)定,法定監(jiān)護人包括未成年人的法定監(jiān)護人和精神病人的法定監(jiān)護人。
(1) 未成年人的法定監(jiān)護人包括:①父母;②祖父母、外祖父母,
關系密切的其他親屬、朋友;③父母所在單位或者其住所地的居民委員會、村民委員會或民政部門等法人組織。擔任法定監(jiān)護人的順序依血緣關系和組織關系的遠近而確定,順序在前者排斥順序在后者。
(2) 精神病人的法定監(jiān)護人包括:①配偶、父母、成年子女。② 其他近親屬如有監(jiān)護能力的祖父母、外祖父母、兄弟姐妹。③關系密切的其它親屬、朋友。④精神病人的所在單位或住所地的居民委員會和村民委員會、當地的民政部門。確定監(jiān)護人也依上列順序進行。
10.非預期不良事件(Unexpected Adverse Event):不良事件的性質、嚴重程度或頻度,不同于先前方案或其他相關資料(如研究者 手冊、藥品說明) 所說明的預期風險。
11.醫(yī)療機構(MedicalInstitution): 經登記取得《醫(yī)療機構執(zhí)業(yè)許可證》的機構。
12.機構倫理審查委員會(Institutional Ethical Review Board):依據國家衛(wèi)健委(原國家衛(wèi)生計生委) 2016 年 10 月 12日正式發(fā)布,自 2016 年 12 月 1日起施行的《涉及人的生物醫(yī)學研究倫理審查辦法》規(guī)定的,負責倫理審查的委員會。
13.可疑非預期嚴重不良反應(SuspectedUnexpectedSerious AdverseReaction,SUSAR),指臨床表現的性質和嚴重程度超出了試驗藥物研究者手冊、已上市藥品的說明書或者產品特性摘要等已有的資料信息的可疑并且非預期的嚴重不良反應。
14.臨床試驗(Clinical Trial):指臨床干預性研究,通常包括新的干預(如新藥臨床試驗)或者已有干預新的使用方法或目的(如擴
大適應證)。
15.臨床研究(Clinical Research):涉及人類受試者的研究,目的是增進醫(yī)學知識,通常包括臨床觀察性研究和干預性研究。
16.利益沖突(Conflict of Interest):當倫理審查委員會委員因與所審查的臨床研究項目之間存在相關利益,影響他/她從保護受試者的角度出發(fā),對研究項目做出公正獨立的審查。利益沖突的產生常見于倫理審查委員會委員與審查項目之間存在經濟上、物質上、機構以及社會關系上的利益關系。
17.利益沖突申明(Disclosure of Conflict of Interest):對是否存在利益沖突的鄭重說明、陳述和解釋。“申明”不同于“聲明”,“聲明”多指公開宣布對某問題和事件的立場而發(fā)表的正式文件,而“申明”強調陳述和解釋。
18.倫理審查委員會(Ethics Review Committee,InstitutionalReview Board):由醫(yī)學專業(yè)人員、倫理學專家、法律專家及非醫(yī)務人員組成的獨立組織,其職責為核查臨床研究方案及附件是否合乎倫理,并為之提供公眾保證,確保受試者的安全、健康和權益受到保護。該委員會的組成和一切活動不應受臨床試驗組織和實施者的干擾或影響。
19.臨床試驗注冊(Clinical Trial Registration):規(guī)范的臨床試驗應在開始實施前在臨床試驗注冊網站注冊并獲取注冊編號;
20.區(qū)域倫理審查委員會(Regional EC/IRB):根據省級衛(wèi)生健康部門制定的管理辦法,在某一區(qū)域內設立的倫理審查委員會,受委托
接受醫(yī)療機構研究項目的倫理審查。
21.數據和安全監(jiān)督(Data and Safety Monitoring):是指審核在研項目中獲得的研究數據,以確保研究過程中受試者的安全與福祉,以及研究的有效性與科學價值。
22.數據和安全監(jiān)督措施(Data and Safety Monitoring Measure):指審核數據結果、報告的事件數據(包括不良反應和非預期的問題),以及研究是否遵從研究方案所采用的方法,以保證研究過程中研究受試者的安全和福祉。
23.數據和安全監(jiān)督委員會(Data and Safety Monitoring Board):由既非研究組織者亦非研究者的獨立專家組成的正式委員會,負責審核一個或多個在研項目(或者多中心研究)的累積數據、關鍵療效終點,以及在整個研究過程中預先設定的數據。該委員會是唯一可以持續(xù)獲得非盲安全與療效數據的研究監(jiān)督組織,通過對風險與受益的評估,做出繼續(xù)、修改、或者終止研究的建議。它可以有權要求補充分析,并可以安排特別會議審核數據。
24.受試者(Research Participant):參加生物醫(yī)學研究的個人 或人群,可以作為試驗組、對照組、或觀察組。一般包括健康自愿者、與試驗目標人群無直接相關性的自愿參加者,或是來自試驗用藥所針對的患病人群。
25.受試者的脆弱性(Vulnerability):脆弱性可以包括(但不限 于) 經濟脆弱性、機構脆弱性、認知脆弱性、社會脆弱性、醫(yī)療脆弱性、遵從脆弱性。
(1) 經濟脆弱性(EconomicVulnerability):指的是受試者在社會品和服務(如收入、住房或醫(yī)療) 分配方面處于不利地位,可能導 致其因研究受益和/或補償的不當引誘而參加研究,從而威脅了他們選擇的自主性,以及受剝削的危險。
(2) 機構脆弱性(InstitutionalVulnerability):受試者因屈從于其他人的官方權威而參加研究。如罪犯、士兵、學生。
(3) 認知脆弱性(CognitiveVulnerability):受試者在不能充分理解信息、仔細思考的情況下做出是否參加研究的決定。
(4) 社會脆弱性(SocialVulnerability):通常受人輕視、歧視 的社會群體,其成員的利益、福利以及對社會的貢獻往往遭到輕視或漠視。社會上脆弱的人也往往是經濟上脆弱的人。
(5)醫(yī)療脆弱性(MedicalVulnerability):指的是患嚴重疾病而沒有滿意指南治療的受試者(如癌癥轉移患者、罕見病患者),可能因其或其醫(yī)生認為準備研究干預是最佳療法而參加研究。
(6) 遵從脆弱性(ComplianceVulnerability):不同于機構脆弱 性,遵從脆弱性是指受試者屈從于社會建構的非官方的權威,如基于性別、種族或階層的不平等,醫(yī)患之間權力和知識的不平等,或者性質更為主觀性的,如父母通常會遵從他們成年兒女的愿望。
26.受試者招募(Recruit):是從潛在研究受試者(參與者) 或受 試者的法定監(jiān)護人獲得有效的知情同意以進行相關試驗的過程。凡涉及人類研究受試者的臨床試驗,應已獲得倫理審查委員會的批準,受試者的招募才能開始。
27.修正案(Protocol Amendment): 對試驗方案,以及有關試驗 組織實施的其它文件及信息的書面修改或澄清。
28.研究(Research):涉及人的生物醫(yī)學研究包括以下活動:
(1) 采用現代物理學、化學、生物學、中醫(yī)藥學和心理學等方法 對人的生理、心理行為、病理現象、疾病病因和發(fā)病機制,以及疾病的預防、診斷、治療和康復進行研究的活動;
(2) 醫(yī)學新技術或者醫(yī)療新產品在人體上進行試驗研究的活動;
(3) 采用流行病學、社會學、心理學等方法收集、記錄、使用、報告或者儲存有關人的樣本、醫(yī)療記錄、行為等科學研究資料的活動。
29.嚴重不良事件(Serious Adverse Event):臨床研究中發(fā)生需住院治療、延長住院時間、傷殘、影響工作能力、危及生命或死亡、導致先天畸形等事件。
30.意外嚴重不良事件(UnexpectedSeriousAdverseEvent):是指任何嚴重不良事件,其特異性或嚴重程度與當前研究者手冊中提供的風險信息不一致。
31.知情同意(Informed Consent):指向受試者告知一項研究的 各方面情況后,受試者自愿確認其同意參加該項臨床研究的過程,須以簽名和注明日期的知情同意書作為文件證明。
32.知情同意書(Informed Consent Form):是每位受試者表示自愿參加某一臨床研究的文件證明。研究者需向受試者說明研究性質、目的、可能的受益和風險、可供選用的其他治療方法以及符合《赫爾辛基宣言》規(guī)定的受試者的權利和義務等,使受試者充分了解后表達
其同意。
33.治療誤解(Therapeutic Misconception):這種涉及人的研究(包括試驗) 在概念上并在實踐上與治療是有區(qū)別的,研究人員以進 行臨床治療的方式開展研究,參加臨床研究的患者往往誤以為接受的是臨床治療,這種情況稱為“治療誤解”。治療誤解不能滿足有關研究的倫理要求,必須加以防止。
34.最低風險(Minimal Risk):最低風險的指南是不高于日常生 活中面臨的傷害,或是在身體或心理的常規(guī)檢查/檢測中面臨的傷害。
第三部分附則
附則一藥物/醫(yī)療器械臨床試驗倫理審查
一、總則
(一) 為加強藥物/醫(yī)療器械臨床試驗倫理審查工作的管理、指導 和監(jiān)督,規(guī)范倫理審查委員會對藥物臨床試驗的倫理審查工作,保證藥物/醫(yī)療器械臨床試驗符合科學和倫理要求,根據《涉及人的生物醫(yī)學研究倫理審查辦法》《藥物臨床試驗倫理審查工作指導原則》《赫爾辛基宣言》《涉及人的健康相關研究國際倫理指南》《藥物臨床試驗質量管理規(guī)范》《醫(yī)療器械臨床試驗質量管理規(guī)范》《國際人用藥品注冊技術協(xié)調會藥物臨床試驗質量管理規(guī)范》(ICH-GCP) 等制定本附則。
(二) 本指南適用于為注冊目的開展的藥物/醫(yī)療器械臨床試驗及 其他為注冊目的開展的臨床試驗,包括體外診斷試劑和特殊醫(yī)學用途配方食品等臨床試驗等。
二、倫理審查委員會的組織與管理
倫理審查委員會應由多學科背景的人員組成,當審查新藥 I 期臨床試驗時,如果委員中缺乏臨床藥理學專家或臨床前研究專家,必要時可以邀請相關專家作為獨立顧問協(xié)助審查。醫(yī)療器械項目涉及材料、電子、機械等專業(yè)領域時,如有必要也可邀請相關領域專家作為獨立
顧問。
三、倫理審查委員會的制度文件
指南操作規(guī)程與倫理審查申請指南等文件,應明確說明針對新藥/醫(yī)療器械臨床試驗的特殊要求,包括但不限于:開展臨床試驗的藥監(jiān)局意見/批件/受理通知或默示許可公示、申辦方資質、試驗藥物/醫(yī)療器械的生產資質、檢驗報告、研究者手冊或藥物/醫(yī)療器械前期研究情況的總結資料、招募受試者的材料等。
四、倫理審查
(一) 藥物/醫(yī)療器械倫理審查特別關注試受試者選擇的合理性和 公正性,應充分考慮藥物/醫(yī)療器械的作用機制及潛在風險,以保護受試者的權益。I 期臨床試驗中可選用健康志愿者為受試者,II、III 期臨床試驗應選擇目標適應癥患者。
當存在以下情況時,I 期臨床試驗可考慮選用患者為受試者:1.作用靶點僅存在于患者;
2.從健康志愿者獲得的藥代動力學數據完全不能外推到目標適應癥患者;
3.健康志愿者難以耐受治療的不良反應等。
如需選擇特殊人群,如兒童、老年人、孕期婦女、患者或其他弱勢群體等進行研究,應有合理的理由,并采取相應保障措施。
(二) 倫理審查特別關注研究者與申辦方、合同研究組織等研究參與方的利益沖突問題。
(三) 藥物/醫(yī)療器械臨床試驗,特別是新藥首次人體試驗,鑒于
對試驗產品的了解有限,應在充分考慮作用機制、臨床前研究結果、國內外已知同類產品的研究結果、風險控制措施等基礎上,對方案的科學性和倫理合理性進行審查。
(四) 藥物/醫(yī)療器械臨床試驗的知情同意書審查時應重點關注:1.介紹使用研究產品的注意事項;
2.研究藥物/器械/檢查項目預期的風險及可能存在未知風險;3.申辦方免費提供的藥物/器械/檢查項目;
4.受試者參加試驗可能獲得的補助;5.發(fā)生損傷之后的處理措施;
6.隱私保護措施(但監(jiān)查員、稽查員、倫理委員會和監(jiān)管部門可 以按相應權限查閱受試者的醫(yī)療記錄);
7.受試者生物樣本的處理等。
(五) 倫理委員會需關注藥物/醫(yī)療器械臨床試驗的受試者招募程 序,建立相關制度或指南操作規(guī)程,對招募受試者的材料進行審查。
(六) 倫理委員會應制定針對藥物/醫(yī)療器械臨床試驗跟蹤審查的 特殊要求,對于新藥首次臨床試驗可縮短跟蹤審查時限,可在適應性設計/分階段開展的臨床試驗的關鍵節(jié)點增加定期跟蹤審查。
(七) 倫理委員會應制定針對藥物/醫(yī)療器械臨床試驗安全性事件 審查的特殊要求,特別關注新藥臨床試驗可疑非預期嚴重不良反應
(SUSAR)。
(八)以患者為受試者的臨床試驗,暫停/提前終止時倫理委員會應關注仍在接受試驗治療的受試者的后續(xù)處理措施。
五、多中心臨床試驗的倫理審查
多中心臨床試驗中各參與中心應根據本中心的研究者和試驗實施的實際情況,充分評估可行性,特別是風險控制能力。
附則二遺傳學和生殖醫(yī)學研究倫理審查
一、總則
為規(guī)范人類輔助生殖技術有關研究、更好地保護涉及遺傳學和生殖醫(yī)學研究的受試者,以及其他涉及收集遺傳數據的臨床研究,根據《涉及人的生物醫(yī)學研究倫理審查辦法》(國家衛(wèi)生和計劃生育委員會2016 年 11 號令)、《涉及人的臨床研究倫理審查委員會建設指南》等,制定本附則。
本指南適應于遺傳學和生殖醫(yī)學臨床研究。遺傳學研究和生殖醫(yī)學研究倫理審查委員會倫理審查應遵循公認的倫理學原則和相關法律規(guī)范。
二、輔助生殖技術臨床研究倫理審查要點
自然的人類生殖過程由性交、輸卵管受精、受精卵植入子宮、子宮內妊娠等步驟組成。輔助生殖技術是指代替上述自然生殖過程某一步驟或全部步驟的手段,主要包括:人工授精、體外受精、胚胎移植、卵/精子和胚胎的冷凍保存、配子輸卵管移植、代理母親、單精子卵胞漿內顯微注射、植入前遺傳學診斷助孕、無性生殖或人的生殖性克隆等。輔助生殖(assisted reproduction) 技術主要解決不育問題,在其發(fā)展過程中也用于解決防止出生缺陷問題。
( 一) 涉及人類輔助生殖技術的研究,受試者均為接受輔助生殖 技術的患者,他們接受輔助生殖技術治療符合國家相關法律法規(guī)和相
關技術規(guī)范,并已經簽署接受輔助生殖技術相關的有效的知情同意書。
(二)由于研究干預通常發(fā)生在妊娠前或早期,需要特別關注子代的健康和利益。必要時研究方案中應納入妊娠期及子代出生后的健康隨訪。受試者和配偶必須具有完全民事行為能力,對研究風險,包括對母親和子代的風險,完全知情。夫妻雙方在研究知情同意書上簽字。
(三)以孕婦為受試者的臨床研究,研究目的必須是為了獲得與孕婦或者胎兒健康相關的知識。如果研究的對象為宮內胎兒,則研究的風險應不大于最低風險,且研究獲取的知識無法通過其他受試者獲得。
(四)以孕婦為受試者的臨床研究,研究干預的安全有效性已經在動物試驗或者非妊娠人群得到驗證,必要時研究方案應納入妊娠期及子代出生后的健康隨訪。孕婦和其配偶必須具有完全民事行為能力,對研究相關風險,尤其是對胎兒可能承受的風險完全知情,孕婦和其配偶有權決定妊娠終止的時間。
三、臨床遺傳學·研究倫理審查要點
人類從受精卵開始到出生以后,是按照基因決定的程序,在一定的自然和社會環(huán)境的影響下發(fā)育和成長。以基因研究為基礎的生命科學和生物技術將更為有效地預報、診斷、治療和預防疾病,提高健康水平,改善生活質量,延長健康壽命,同時它們也會引起一系列的倫理、法律和社會問題。遺傳學生殖研究中涉及的倫理、法律和社會問題更為復雜和尖銳。對涉及遺傳學臨床研究的倫理審查,要求對該領
域的相關問題有敏感性,確保開展對受試者、后代乃至對全人類社會負責任的臨床研究。
(一)合法合規(guī)
在遺傳學研究,包括遺傳疾病診斷、遺傳疾病篩查、收集遺傳信息進行探索性的研究中,對遺傳信息的收集、管理和使用必須符合國家現有法律法規(guī),遺傳數據只能用于促進人類的健康和福祉。
(二)知情同意
1.受試者對是否接受與研究目的相關的遺傳學檢查以及是否為研究提供遺傳學數據應完全知情并自愿。
2.應詳細告知受試者對遺傳數據的收集目的、收集方法(包括介 入性或非介入性方法)、數據的處理(匿名化)、數據的使用以及數據 的保管等。數據的使用不得超過知情同意告知的范圍。
3.如果需要利用剩余標本或者遺傳數據進行其他目的的研究,必須再次獲得受試者同意并經倫理審查委員會批準。
(三)信息共享
去標識化后的遺傳數據可以在研究者之間自由共享。
(四)隱私保護
1.人類基因組是人類共同遺產的一部分,原始基因序列數據應由全人類共享,但個體對自身的遺傳信息有基因隱私權。
2.臨床研究相關的遺傳學檢查的結果,無受試者的授權不得告知第三方。
3.意外發(fā)現的告知。如果臨床研究結果有意外發(fā)現,且該發(fā)現可
能與受試者家系其他人員的生命和健康風險相關。研究人員和醫(yī)務人員為了避免受到傷害而向其泄露相關信息,這在倫理學上應該允許,甚至是義務的,但需要通過正當途徑,且避免暴露受試者隱私。
4.如果研究結果有意外發(fā)現,研究方法可靠準確,患病的風險目前可防可控,應建議受試者接受臨床診療。
5.當研究意外發(fā)現受試者為嚴重遺傳病的先證者,家系發(fā)病風險很高而且有臨床干預方法時,研究者應建議并鼓勵受試者向相關親屬披露信息并及時接受臨床診治。
6.當未能說服受試者將遺傳信息告知相關家人時,研究人員可以披露該信息,但應符合下列條件:
(1) 潛在的傷害是嚴重的;
(2) 如不告知,對家庭成員傷害的概率高,告知后可能有效避免 傷害;
(3) 應該僅僅告知避免傷害所必需的信息。
(五)產前診斷研究
1.產前遺傳疾病診斷研究,必須以目前公認可靠的方法進行遺傳學檢測,明確告知受試者診斷的目的、結果的可靠性以及可能的后果,受試者自主決定是否接受檢測。
2.診斷方法的研究,同時應以金標準的方法作自身對照研究,并將金標準方法檢測的結果告知受試者及其配偶。
(六)地域群體的保護
遺傳病篩查是針對已經有有效防治措施的遺傳病進行的人群易感
性的檢測。檢測結果可能涉及某個特定的地域、民族或者種族。研究除獲得個體知情同意外,需要重視文化、社會及價值觀的差異,注意對特定人群的保護。對遺傳信息進行嚴格保管和保密,包括進行編碼和去標識化處理,對接觸遺傳數據的人員進行限制,數據發(fā)表時需充分考慮對具體地域群體的不利影響。
(七)遺傳咨詢
1.應該向受試者提供專業(yè)的遺傳咨詢,特別是對于嚴重程度高的遺傳性疾病。
2.受試者夫婦對可能受累的胎兒有生育決定權.
3.對于有出生缺陷的孩子應該有隨訪建議。
(八) 利益沖突申明和管理
遺傳學信息是具有高度個體化、對個人和家庭有終生含義的信息。遺傳學信息的檢測結果對患者生活的影響將伴隨其一生,即使?jié)撛诨?/span>病的診斷也可能造成污名化或者歧視。在遺傳學相關研究中,研究人員、申辦企業(yè)和進行遺傳學檢測的機構必須申明之間的利益沖突,并經倫理審查委員會詳細審核。
附則三精神醫(yī)學臨床研究倫理審查
一、總則
精神障礙問題對人類社會產生了深刻影響,精神障礙不僅對患者本人生活質量帶來深刻的負面影響,也導致社會公眾對精神疾病產生深切的關注。在臨床醫(yī)學中,沒有一個學科像精神病學那樣,從基本概念到疾病分類,從診斷指南到收治的指南乃至程序,都充滿著激烈的爭議。這些爭論不僅影響著現代精神病學的發(fā)展走向和臨床實踐,無疑也影響著對精神病學的臨床研究。
精神障礙者屬于研究受試者中的弱勢人群,往往無法有效維護自己權利和利益。他們的“弱勢”來源多重,可能存在認知上的缺陷,遵從上的不足,以及醫(yī)療上的特殊性。在臨床研究中,倫理學關注的是由于受試者的脆弱性,可能被以倫理上不適當的方式招募為研究的受試者,置于不適當的風險之中。
本附則適用于精神醫(yī)學臨床研究倫理審查中一些需要特別關注的問題。本指南的制定依據《中華人民共和國精神衛(wèi)生法》《上海市精神衛(wèi)生條例》《涉及人的臨床研究倫理審查委員會建設指南》《涉及人的生物醫(yī)學研究倫理審查辦法》《人類遺傳資源管理條例》《藥物臨床試驗倫理審查工作指導原則》,以及世界精神病學協(xié)會(WPA)《關于精神疾病患者權利和法律保障的宣言和觀點》(1989)、聯合國大會頒布的 《保護精神病患者和改善精神保健的原則》(1991 年聯合國大會 46/
119 號決議),以及世界衛(wèi)生組織(WHO)《精神衛(wèi)生資源手冊:人權與立法》(2005) 等國際通用的倫理準則。
二、倫理審查要點
(一)臨床研究設計
1.精神障礙患者作為受試者參加臨床研究時,該臨床研究獲得的知識必須有益于精神障礙人群自身,即能夠解決精神障礙人群優(yōu)先需要解決的醫(yī)療問題。
2.不應該對精神障礙的弱勢受試者進行僅僅有利于其他人群而對受試人群現在或未來均無益的研究。
3.研究內容涉及對受試者不可避免的心理創(chuàng)傷體驗時,應當事先設計有提供心理咨詢的服務。
4.盡量降低研究過程對精神障礙受試者可能造成的風險。
5.禁止對精神障礙患者實施與治療其精神障礙無關的實驗性臨床醫(yī)療。
(二)受試者的選擇
1.只有當其他受試者無法取代精神障礙患者作為受試者時,才可以選擇招募精神障礙患者作為研究的受試者。
2.只有當疾病嚴重程度較輕的患者不適合作為受試者時,才可以選擇疾病嚴重程度較重的精神障礙患者作為研究受試者參加臨床研究。
(三)有效的知情同意
1.應該關注到,精神障礙患者的作為研究受試者時,他們知情同
意的能力可能處于動態(tài)變化之中,對此類受試者應該采取動態(tài)征得知情同意的方式,在研究方案中應該明確,必要時增加知情同意的頻次。
2.避免引誘和變相強迫精神障礙患者參加臨床研究,要明確告知,不參加研究也不會對他們的正常醫(yī)療造成任何負面影響。
3.征得臨床研究的候選受試者的知情同意時,應特別注意避免“治療誤解”。
4.當受試者知情同意能力可能處于動態(tài)變化時,當受試者喪失或部分喪失知情同意能力時,需要征得受試者法定監(jiān)護人的代理同意。征得代理同意后的研究方可開始或繼續(xù)進行。
5.對于知情同意能力部分受損的受試者,根據受試者表達意愿的能力程度,在征得其法定監(jiān)護人代理同意的同時,也應該給予受試者本人對參加臨床研究是否贊同的機會,并尊重受試者本人的贊同與否的意愿。
6.研究受試者是精神病院長期住院治療的患者時,可能與醫(yī)生和研究人員存在依賴關系或易受影響,受試者通常“很難拒絕”參與研究。倫理審查委員會應特別關注研究的目的,以及參與研究的風險和獲益比是否合理。
(四)受試者隱私保護
1.涉及公布敏感研究結果時,尤其需要尊重受試者本人及其利益相關者(包括其親屬) 的意愿。
2.公布統(tǒng)計學數據時,可能由于涉及地域社區(qū)等信息而對社區(qū)造成污名化或歧視的風險,也應給予特別的關注。
附則四公共衛(wèi)生領域臨床研究倫理審查
一、總則
公共衛(wèi)生的目標旨在了解群體不良健康和良好健康的條件和原因,尋求一種能夠使人們保持健康的優(yōu)良環(huán)境。其工作的目的是監(jiān)測和評價群體的健康狀況,制定戰(zhàn)略和干預措施。公共衛(wèi)生的目標是群體健康,是通過政府或公共機構而實現的集體的行動。
公共衛(wèi)生領域的研究通常旨在系統(tǒng)收集或分析數據的任何社會科學、生物醫(yī)學或流行病學的活動,為了產生主要有益于在承受參加風險的社群之外那些社群的目的。公共衛(wèi)生機構搜集和分析可辨識身份的健康數據,產生可被普遍化的預防疾病或促進健康知識。
對公共衛(wèi)生研究項目的倫理審查,應包括公共衛(wèi)生領域專家以及如流行病學專家,如倫理審查委員會成員不涵蓋所審查項目領域的專家,應特別邀請專家參與倫理審查。研究設計受試者為敏感社區(qū)和人群時,必要時應尋求該領域或社區(qū)代表的咨詢意見。
二、倫理審查要點
(一) 公共衛(wèi)生實踐與公共衛(wèi)生研究的區(qū)分1.公共衛(wèi)生實踐
公共衛(wèi)生的實踐活動包括廣泛搜集和分析多種來源的可辨識身份的健康數據(例如人口學和健康調查),以實施系列公共衛(wèi)生活動,包括監(jiān)測、流行病研究以及評價和監(jiān)督。這些調查的的目的是為了指導
政策,而不是產生新的知識,雖然往往包括一些研究性的問題,這些基本的公衛(wèi)活動屬于公共衛(wèi)生實踐。應該對公共衛(wèi)生的實踐活動與公共衛(wèi)生研究活動加以區(qū)別。實踐與研究的差異不僅具有不同的操作后果(體現于如何設計并執(zhí)行所研究的干預措施以便得出有效的結論),而且也有不同的道德含義。
公共衛(wèi)生實踐的特點包括:
(1) 有法律特別授權,有相應的政府義務來從事保護公眾健康的 活動;
(2)由公共衛(wèi)生機構直接實施或監(jiān)管,并對公眾負責;
(3) 可合法地使并非自愿參加或未表示知情同意的人參與;
(4) 尊重個體的尊嚴和權利,可得到公共衛(wèi)生倫理互助原則的支 持。
2.公共衛(wèi)生研究
公共衛(wèi)生研究的目的是產生新的知識,受試者包含整個社區(qū)或人群。在公共衛(wèi)生研究中受試者暴露于操控、干預、觀察或其他與研究人員的直接的互動之中,暴露于環(huán)境的改變之中,或通過研究者搜集、制備或使用可識別個體的生物學材料、醫(yī)學或其他記錄。
例如,當研究目的是檢驗新干預(例如藥物或疫苗)的效果時,研究與治療的主要區(qū)別是,進行治療使特定患者受益,而進行研究是獲得新的科學知識。例如公共衛(wèi)生機構進行雙盲對照研究,以評估一種新的疫苗在隨機選擇的人群中的效果。這種研究的假說、方法和作為其基礎的目的就支持將這種活動分類為研究。對于研究的倫理審查
要求,研究設計采取一系列的保護措施(如在不存在豁免時的個人知 情同意) 和程序,保護人類受試者的健康、安全和自主權。
公共衛(wèi)生研究的受試者可以包括健康志愿者,也可以包括整個社區(qū)或人群。
3.公共衛(wèi)生研究與公共衛(wèi)生實踐的區(qū)分
將公共衛(wèi)生實踐與研究加以區(qū)分是重要的,公共衛(wèi)生研究需要堅持履行倫理審查程序。根據其活動的性質屬于公共衛(wèi)生實踐還是公共衛(wèi)生研究,對于是否要求個人書面授權,向公共衛(wèi)生從業(yè)人員泄露可識別身份的健康信息,以及研究人員對這些可識別身份的健康信息(包括標本和數據) 使用的指南是不同的。為研究目的而獲得可識別身份的健康信息的倫理學要求更高,因此對獲取這些信息的要求更為嚴格。區(qū)分的關鍵:
(1)活動的目的
公共衛(wèi)生研究是追求獲得有關公共衛(wèi)生干預的普遍性知識。公共衛(wèi)生實踐是為了在特定情境下保護目標人群的健康。
(2)所使用方法
公共衛(wèi)生研究的方法是尚未被證明是安全和有效的;而公共衛(wèi)生實踐使用方法是經過檢驗,獲得證據證明為安全和有效的,而該活動是已經得到證明安全有效的方法的應用。
在有些情況下,公共衛(wèi)生實踐與公共衛(wèi)生研究是結合在一起的,難以明確區(qū)分。在這種情況下,區(qū)分可能不是最重要的。更重要的是倫理委員會如何確定其中存在的倫理問題,并加以考量。
(二)研究設計
在公共衛(wèi)生研究中,研究設計應關注符合通用倫理準則、此外應注意研究受試社區(qū)的文化情景、關注人群中健康不平等和易受影響的人群以及對研究成果受益的可及性的重要性。
1.研究要對研究所在地的和社區(qū)的社會、文化、政治和經濟的情境具備敏感性;
2.研究的設計應該避免對受試地區(qū)和人群的不當利用;
3.研究應該有助于增進受試社區(qū)增進衛(wèi)生系統(tǒng)的能力以及減少健康不平等。
(三)風險和傷害的評估
公共衛(wèi)生研究可能引起與對身體的傷害有所不同的其他類型的傷害。這些傷害可能比臨床研究相關對受試者的潛在身體傷害更為嚴重,包括(但不限于):
1.探索有關受試者行為敏感信息的社會行為學研究,可使受試者的行動或回答為他人所知,從而有可能引起社會或心理的傷害。
2.進行大規(guī)模臨床試驗前進行研究。雖然形成性研究往往是無害的,但也有可能引起對社區(qū)的傷害或使社區(qū)處境尷尬。
(四) 觀察性流行病學研究
在公共衛(wèi)生研究中流行病學研究占主要地位。通常流行病學研究使用兩種類型:觀察性研究(說明性、群組性、對照性和橫斷面性);干預或實驗性研究。大多數流行病學(說明性的、橫斷面的、群組或 隊列的) 研究僅僅是觀察性的,并無預防或治療的干預。
1.數據的保密
隨著對研究中倫理問題日益受到廣泛關注,對傷害(對受試者的潛在的傷害)的認識不斷深入,對受試者的隱私保護問題也越來越受到關注,所有這一切對觀察性流行病學研究具有重要意義。
不同類型的數據其身份可追溯性是不同的:
(1) 匿名數據:收集到的數據沒有身份標識符,從未與某個人聯 系起來。例如通過郵寄寄回的問卷,沒有姓名和地址。
(2) 匿名化數據:以前可辨認身份的數據已經去標識;任何可聯 系到特定個人(例如身份證號碼、信用卡號碼、甚至手機的系列號)的信息已被消除,第三方處理信息時也不可能重建這些信息。
(3) 假名數據:數據記錄不含明晰的身份標識,雖有明確的身份 標識符,但無法用來直接將信息聯系到某個特定的個人。這樣保護個人信息和數據不被泄露,因為這種身份標識符不能轉化為明確的身份識別。
(4) 清晰的個人數據:這是最容易追溯識別到個人的信息,因為 這種數據記錄含有明確的身份識別信息。
2.研究風險與隱私保護
一個人的信息可被有意或無意地泄露而使受試受到傷害。有些信息特別有可能引起傷害,可能會造成社會污名化、歧視,造成精神和社會適應性上的傷害。
受試者隱私泄露可能成為觀察性研究的最大風險,數據的保密成為最為受到關注的問題。
(1)遺傳數據的保護
遺傳數據難以匿名化,因為至少在理論上可以把這些數據與另一有遺傳信息和標識符的生物學樣本聯系起來,對于遺傳數據的應該有更多的保護措施。
(2)標識身份的數據
有些研究無法用匿名數據完成,特別是研究者需要標識符將一種記錄與另一組記錄聯系起來,雖然研究結束可將數據匿名化,但在研究期間因信息泄露的風險始終存在。因此不應認為參加研究的風險必定可以被消除。重要的是,不僅要評估在研究中獲得或產生的有身份標識的私人信息可被不適當泄露的可能性,也應評估如果泄露實際發(fā)生傷害的可能和程度如何。
(3)推演辨識(deductiveidentification)
在有些研究中,雖然標識身份的信息(例如姓名) 可從數據或樣 本除去,留下的數據仍可指向某一個或一些人,即可以通過推演辨識出受試者。例如有一數據集涉及一特定城鎮(zhèn)或城區(qū)的人,人們可從受試者的性別、年齡、種族、職業(yè)、及所住街區(qū)的信息推演辨識出這個人是誰。
(4)社區(qū)傷害
有時研究報告也可以使社區(qū)受到傷害。當研究單元是社群,如果發(fā)表的研究成果能使人們辨識出是哪個社群,而且研究結果以負面的色彩描繪該社區(qū)或社群的話,他們就很容易受到傷害。如 HapMap 研究,雖然樣本并不存在個人標識,但知道這些樣本來自中國北京,日本東
京,還是尼日利亞。
(5) 大數據處理的隱私保護
越來越多的公共衛(wèi)生信息用大數據技術處理,在大數據時代,隱私的喪失更容易發(fā)生。因此,在觀察性流行性病學研究中,研究人員和倫理審查都面臨著更為艱巨的對受試者隱私和數據保護的挑戰(zhàn)。
附則五中醫(yī)藥臨床研究倫理審查
一、總則
中醫(yī)藥臨床研究與現代西方醫(yī)學臨床研究所遵循的基本倫理原則完全一致。根據中醫(yī)藥臨床研究的自身特點,為進一步規(guī)范中醫(yī)藥臨床研究倫理審查委員會建設,加強對中醫(yī)藥臨床研究中受試者的保護,特制定本附則。本附則是《涉及人的臨床研究倫理審查委員會建設指南》之附則,是對基本指南的補充。
本附則依據《中華人民共和國中醫(yī)藥法》、《中醫(yī)藥臨床研究倫理審查管理規(guī)范》、《中藥注冊管理補充規(guī)定》、《中藥新藥臨床研究一般原則》和《涉及人的生物醫(yī)學研究倫理審查體系要求》等法規(guī)及指南制訂。
本附則適用于開展中醫(yī)藥臨床研究的醫(yī)療衛(wèi)生機構。
二、組,織管理
( 一) 倫理審查委員會委員和獨立顧問。開展中醫(yī)藥臨床研究較 為集中的醫(yī)療衛(wèi)生機構,在組建倫理審查委員會時,必須選擇適當數量具有相關專業(yè)背景的委員。較少開展此類研究的綜合性醫(yī)療衛(wèi)生機構倫理審查委員會如果無相關專業(yè)背景的委員,在審查此類研究項目時應聘請能夠勝任咨詢工作的獨立顧問,由獨立顧問對其科學性提供客觀公正的咨詢意見。
三、倫理審查
(一)研究方案的審查
1.中醫(yī)藥與現代西方醫(yī)學的主流體系屬于兩種不同范式的醫(yī)學,兩者對醫(yī)理的解釋、疾病的概念以及方法論的運用均有不同。在對中醫(yī)藥臨床研究項目設計的評估中應該充分考慮其特點,在充分保障受試者安全的基礎上,兼容并蓄,努力加以探索。
2.中醫(yī)藥臨床研究應以中醫(yī)藥理論為指導,運用中醫(yī)藥技術方法,并符合國家中醫(yī)藥行業(yè)主管部門制定的相關法規(guī)要求。
3.中醫(yī)藥臨床研究應符合其公認的理論原則和方法,并尊重積累多年的臨床經驗。長期傳統(tǒng)醫(yī)學實踐和經驗可以作為中醫(yī)藥臨床研究的前期證據。
4.來源于“古代經典名方的中藥復方制劑”以及“主治為證候的中藥復方制劑”兩類有臨床應用基礎的中藥研究,可以無需提供動物藥效試驗,但必須進行非臨床的安全性研究,確保用藥安全。
5.處方中含有毒性藥材、無法制定指南的原料或非臨床安全性實驗發(fā)現有明顯毒性反應的中藥,應當首先進行Ⅰ期臨床試驗,而不能直接進行 II 期、III 期臨床試驗。
6.研究設計應充分考慮當前現代醫(yī)學有效的和可得的臨床干預方法,并將受試者的健康利益置于首位。
7.中醫(yī)藥已不再局限于傳統(tǒng)醫(yī)學范疇。高風險的研究項目應先行提交同行專家評議,獲得對項目的評估意見。倫理審查委員會同時審查研究項目的科學價值和社會價值。
(二)知情同意書的審查。
1.知情同意書應明確說明該研究目標疾病目前已有的不同醫(yī)學診斷方法和/或治療現狀,給予受試者充分選擇的自由。
2.知情同意書應注意對中醫(yī)藥特有術語和理論進行通俗易懂的解釋。
四、術語及其定義
( 一)中醫(yī)藥:是包括漢族和少數民族醫(yī)藥在內的我國各民族醫(yī)藥的統(tǒng)稱,是反映中華民族對生命、健康和疾病的認識,具有悠久歷史傳統(tǒng)和獨特理論及技術方法的醫(yī)藥學體系。
(二) 傳統(tǒng)醫(yī)學:是在維護健康以及預防、診斷、改善或治療身心疾病方面使用的種種以不同文化所特有的無論可否解釋的理論、信仰和經驗為基礎的知識、技能和實踐的總和。
附則六干細胞臨床研究倫理審查
一、總則
干細胞臨床研究遵循國家衛(wèi)生計生委與食品藥品監(jiān)管總局頒布的《干細胞臨床研究管理辦法(試行)》和《干細胞制劑質量控制及臨床前研究指導原則(試行)》。
干細胞臨床研究的主要目的是對臨床前的研究結果進行安全性和有效性驗證,為減輕及預防人類因疾病和損傷帶來的痛苦提供有效的治療手段。患者參與臨床研究是相信這些研究已經通過了很好的臨床前試驗的驗證,而且參加該研究獲得潛在受益與可能承受的風險和負擔是合理的;醫(yī)生和公眾可以確信,國家相關機構基于臨床研究獲得的臨床證據而做出的重大醫(yī)療決策是縝密而且公正的。
干細胞臨床研究除遵循通用倫理準則之外,還需要專門適用于干細胞臨床研究的倫理要求,包括使用人類胚胎和生殖細胞的臨床研究、某些細胞干預型研究可能對受試者有不可逆的風險、目前缺乏有效治療方法的重癥患者極度脆弱性及其醫(yī)療需求的迫切性、患者和公眾對醫(yī)療領域發(fā)展及其可及性的高度期望等情況。
干細胞臨床研究的目標是推動對臨床醫(yī)學科學知識的認知以及優(yōu)先滿足醫(yī)療和公眾的健康需求。在臨床研究中,臨床醫(yī)生和研究人員對避免將受試患者置于傷害和危險之中負主要責任。包括實驗性干預試驗,是細胞治療臨床轉化前必須完成的過程,而且需要人類受試者
參與,應保證臨床研究所獲得的專業(yè)信息的完整性可靠性,所獲得的專業(yè)信息將用于指導患者、醫(yī)生、臨床研究人員做出相關重要決策。
在干細胞療法的安全性和療效進行嚴格且獨立的專家審查之前,就將其市場化以及應用于大量的患者的行為,有違醫(yī)學倫理。
二、倫理審查要點
申辦方、臨床研究人員、研究實施醫(yī)療機構、監(jiān)管機構均負有責任確保臨床試驗符合倫理。與所有的臨床研究一樣,干細胞干預的臨床試驗必須遵循國際國內公認的倫理準則、科學性要求及保護受試者原則。
(一)機構要求
1.申請開展干細胞臨床研究倫理審查的機構必須是已獲得國家干細胞臨床研究備案的機構。
2.國家批準的干細胞研究備案機構必須建立專門的干細胞研究學術委員會和干細胞研究倫理審查委員會。
3.確保干細胞臨床研究倫理審查之前已獲得學術評審通過。
4.對干細胞臨床研究還需要根據有關規(guī)定進行額外的獨立研究評估,包括接受國家權威管理部門或授權機構要求的分級審查或審核。
(二)研究設計
1.所有涉及干細胞干預的臨床研究,須首先提交干細胞同行專家進行學術評審,對被提議的干細胞臨床試驗設計科學性和有效性做出科學判斷。學術委員會和倫理審查委員會均應對臨床研究的價值進行審慎的考察。如果沒有相關學術文獻可供參考,倫理審查必須基于專
業(yè)和專家意見做出判斷。
2.對比較新的干細胞干預建立的治療模型,可能沒有預先設計的研究方案,且無法提出指南試驗設計。對于這類研究,以創(chuàng)新性醫(yī)療方法進行評估更為合適。有前景的創(chuàng)新性治療策略應該在大規(guī)模應用前,盡早對其進行系統(tǒng)評估。
(三)倫理審查成員
1.倫理審查委員會對干細胞臨床研究方案審查時,參加審查的成員必須包括具有能力評估干細胞臨床前研究的專家。
2.參加審查的成員中應包含有能力評估臨床試驗設計的專家,包括統(tǒng)計學分析專家和與疾病相關的特殊問題的臨床專家。
3.參加審查的成員應當至少包含一名從事過干細胞相關基礎、產品研發(fā)或臨床研究三年以上經歷的研究人員。
(四)知情同意
1.研究人員、臨床醫(yī)生與醫(yī)療機構應該讓受試者在有足夠決策能力的情況下行使有效的知情同意。無論是在科研還是醫(yī)療的背景下,都應該向受試者提供有關干細胞創(chuàng)新療法風險的確切信息,以及干細胞創(chuàng)新療法的發(fā)展現狀。
2.如果受試者缺乏自我決策能力,應該采用法定監(jiān)護人代理同意,并且嚴格保護受試者避免由于非治療程序的增加帶來的風險超出最低風險。
3.當對缺乏知情同意能力的受試者進行干預療法試驗時,研究過程中出現的風險應該限制在最低風險,除非與之相關的治療獲益遠大
于風險。
4.在法定監(jiān)護人的代理同意情況下,如果細胞干預臨床研究或替代療法研究進程中有大的風險與受益比的改變,必須重新獲得法定監(jiān)護人的知情同意。
(五)受益與風險的評估
1.應該使用有效的設計以降低風險,用最低數量的受試者來適當解答科學問題。
2.基于目前的科學理解,由于對胎兒潛在的風險,不允許招募孕婦作為受試者參加干細胞臨床研究是正當合理的。
(六) 如果臨床研究涉及使用來源胚胎的干細胞,應該嚴格審查來源和使用的合法合規(guī)。
(七) 使用超出常規(guī)研究的干細胞干預應該是可循證的、受獨立的專家審查并且著眼于患者的最佳利益。有前景的創(chuàng)新性治療策略應該在大規(guī)模應用前,盡早對其進行系統(tǒng)評估。
(八)會議審查要求
1.干細胞臨床研究倫理審查有效,必須滿足以下條件:
(1) 須有三分之二以上法定出席成員同意;
(2) 到場的成員中熟悉干細胞相關研究的具有高級職稱的研究人 員,投贊成票。
2.倫理審查委員會應對研究者的利益沖突申明進行評估,確保可能產生研究設計偏差的利益沖突(經濟與非經濟) 最小化。
3.干細胞臨床研究資料包括倫理審查資料需要至少保存 30 年。
附則七人體器官移植臨床應用與研究倫理審查
一、總則
( 一) 為保障人體器官捐獻與移植人合法權益,倡導捐獻人體器 官挽救生命的人道主義精神,規(guī)范人體器官捐獻與移植倫理審查工作,根據《人體器官移植條例》《涉及人的生物醫(yī)學研究倫理審查辦法》《涉及人的臨床研究倫理審查委員會建設指南》《世界衛(wèi)生組織人體細胞、組織和器官移植指導原則》及《涉及人的生物醫(yī)學研究倫理審查辦法》制定本附則。
(二) 具有人體器官捐獻與移植臨床資質和科研能力的機構必須按照國家衛(wèi)生健康委員會要求,設倫理審查委員會并能保障倫理審查工作獨立開展。在國家法律、法規(guī)和相關部門規(guī)章制度規(guī)范下,對人體器官捐獻和移植的合法性、倫理性及人體器官器官移植(藥物) 臨 床研究的科學性、倫理性進行獨立審查,并接受相關管理部門的指導和監(jiān)督。倫理審查委員會對器官移植風險和受益評估的程序和指南,是否有對可能和不確定事件后果的判斷。
(三) 本附則適應于人體器官移植臨床應用及人體器官移植(藥物) 臨床研究項目。人體器官移植倫理審查委員會倫理審查應遵循科學、獨立、公平、公正、及時原則,并遵守國家有關規(guī)定。
二、器官移植臨床實踐的倫理審查要點
(一)審查委員會
人體器官移植倫理審查委員會應在具備人體器官移植診療科目登記的醫(yī)療機構或區(qū)域人體器官移植中心(市、省、地區(qū)、全國) 設立 并開展獨立的倫理審查。
委員組成應包含移植醫(yī)學、倫理學、病原微生物學、動物傳染病學、法學、社會學等領域的專家和非本機構社會人士,有擔任過相關學科培訓和器官移植技術應用相關評審的經歷。從事人體器官移植的醫(yī)務人員人數不得超過委員會委員總人數的四分之一,與醫(yī)療機構無隸屬和利益關系的人員不少于委員會委員四分之一。
倫理委員會會議記錄、倫理審查案例資料及相關文件保存時間至少七年以上。
(二)利益沖突
參加審查的委員應與本例次人體器官移植無利益沖突,有下列情形之一者,應即回避:
1.參與死亡判定、施行器官摘取或移植手術的醫(yī)師。
2.與捐贈者或待移植者有配偶、四親等內血親或三親等內姻親或曾有此關系。
3.有其他事實證明有偏頗嫌疑者。
4.與人體器官臨床試驗項目申請人、參與人有利益關系者。
5.其他倫理決議認為應回避情形。
(三)保密及隱私保護
人體器官移植倫理審查委員會委員及管理人員需簽署保密協(xié)定,保護患者及捐贈者信息。
(四)倫理審查范圍
1.人體器官移植倫理審查委員會審查范圍包括摘取人體器官捐獻人具有特定功能的器官(例如:心臟、肺臟、肝臟、腎臟、胰腺及小 腸等) 全部或者部分,將其植入接受人身體以治療或替代其病損器官的過程。
2.細胞、角膜、骨髓等人體組織移植倫理審查,不適用本指南。
3.嚴禁對人體頭部(含全腦)、頭部以下的整體軀干、性腺(睪丸、卵巢) 及異種器官進行臨床移植。
4.遵行“非不得已,不得為之”原則,優(yōu)先考慮其他更為適宜治療方法。
(五) 人體器官移植倫理審查委員會有責任努力保障器官分配的公平與公正。包含并不限于以下方式:
1.查詢中國人體器官捐獻管理中心登記系統(tǒng)、施予受器官捐獻志愿登記系統(tǒng)、中國人體器官分配與共享系統(tǒng)(COTRS)、相關 opo 組織及各省、市、自治區(qū)衛(wèi)生行政主管部門人體器官移植管理系統(tǒng)。
2.在條件允許的情況下可以邀請器官捐獻者親屬/本人參與器官移植倫理審查。
3.確保遺體器官獲取必須經專科醫(yī)師判定患者死亡后由器官獲取組織(OPO) 實施。
4.腦死亡判定做出后,且符合以下情形之一的,允許器官捐獻:
(1) 在患者生前明確表示器官捐獻意愿,經患者配偶、直系親屬 確認捐獻意愿并同意捐獻。
(2) 患者生前沒有明確表示拒絕器官捐獻,在患者配偶、直系親 屬均同意捐獻并簽署捐獻同意書,允許進行器官獲取。
5.活體器官捐獻的接受人限于活體器官捐獻人的配偶、直系血親或三代以內旁系血親,或者有證據證明與活體器官捐獻人存在因幫扶等形成親情關系(因幫扶形成的親情關系應僅限于養(yǎng)父母和養(yǎng)子女、 繼父母和繼子女關系) 的人員。
6.活體器官捐獻者須為十八歲以上,有完全民事行為能力的自然人。未滿十八歲的,盡管其自愿且經法定監(jiān)護人書面同意,也不得活體器官捐獻。但未滿十八歲的腦死亡者,經法定監(jiān)護人書面同意,且經倫理委員會審查批準,允許捐獻器官。
(六)醫(yī)院施行活體器官捐獻移植手術前,應將下列文件提交人體器官移植醫(yī)學倫理委員會審查通過:
1.捐獻人書面同意及其近親屬的書面證明。
2.捐獻人與待移植者姓名、出生年月日、性別、親屬關系之資料及證明。
3.捐獻人心理、社會、醫(yī)學評估資料。
4.十八歲以下未成年人捐獻器官須征得其法定監(jiān)護人的書面同意(僅限遺體器官)。
5.等待移植者的移植手術適應癥和禁忌癥等評估資料。
6.醫(yī)療機構及執(zhí)業(yè)醫(yī)師證明材料。7.法律規(guī)定的其他證明材料。
(七) 捐贈者捐獻活體器官后,負責審查的人體器官倫理委員會
需定期對捐贈者進行跟蹤隨訪,對有需要定期進行檢查的捐獻者,倫理審查委員會有權要求實施其器官移植醫(yī)院或醫(yī)師應給予協(xié)助。
(八) 人體器官移植倫理審查委員會須對器官摘取、保存、運輸、分配及使用的科學性、公平性及倫理性進行監(jiān)督審查。
三、器官移植臨床研究及人體器官移植(藥藥物)的倫理審查
( 一) 人體器官移植倫理審查委員會在對器官移植相關臨床研究 倫理審查時,要求申請的器官移植臨床研究項目已經對其科學性進行了充分的評審,并已經收到書面評審意見。
(二) 參加倫理審查的成員須包括器官移植臨床專家,且不直接參加該研究。必要時可聘請專家作為研究評審顧問。
(三) 在對涉及較大風險的人體器官移植臨床研究項目倫理審查前,要求移植團隊提供書面科學性評審報告以及對研究項目潛在風險的評估報告,并申請中國器官捐獻與移植委員會協(xié)助審查或提供咨詢意見。
(四) 人體器官移植倫理審查委員會的審查以投票表決的方式作出決定,經全體委員人數的2/3以上同意的決定方可有效。
(五) 人體器官移植倫理審查委員會對器官移植相關研究實施過程進行監(jiān)督,有權要求申請人及相關負責人解釋說明。
(六) 研究人員需要向倫理審查委員會提交利益沖突申明,并經倫理審查委員會進行評估。
附則八突發(fā)重大疫情風險時相關醫(yī)學研究倫理審查
一、總則
出現突發(fā)重大疫情風險時,開展相關醫(yī)學研究應首要保證疫情應 對與疫情防控以及醫(yī)療救治的開展,旨在能夠解決疫情中的緊迫問題,以快速提高公共衛(wèi)生與醫(yī)療體系應對疫病的能力。首先考慮開展針對疫情風險的病原、傳播機制、易感人群以及疫苗、診斷試劑、藥物、新技術和新干預方法等預防、控制、診斷、治療和康復的研究。
為確保在出現突發(fā)重大疫情風險時能夠有序、規(guī)范、高效地開展相關醫(yī)學研究,保證倫理審查委員會的審查時效和審查質量,提高疫情應對能力,保護研究參與者的合法權益,維護人的尊嚴、生命和健康,制定本附則。
本附則適用于突發(fā)重大疫情風險時開展涉及疫情風險相關的醫(yī)學研究的倫理審查工作,作為《涉及人的臨床研究倫理審查委員會建設指南》(以下簡稱《指南》) 的附則,是對《指南》的補充。
本附則也適用于出現其他突發(fā)公共衛(wèi)生事件或風險時開展的相關醫(yī)學研究項目的倫理審查。
二、組,織管理
( 一) 倫理審查委員會應預先制定倫理審查的相關制度和流程,以滿足突發(fā)重大疫情風險時開展的相關醫(yī)學研究的倫理審查需求。根據《中華人民共和國傳染病防治法》、《突發(fā)公共衛(wèi)生事件應急條例》、
《國家突發(fā)公共衛(wèi)生事件應急預案》等法律法規(guī),出現突發(fā)重大疫情風險時,應遵照本附則的規(guī)定實施。
(二) 倫理審查委員會應預先確立遠程審查與討論平臺,建立與研究及相關人員的溝通機制,以利于便捷開展工作。
(三) 倫理審查委員會應對擬承擔倫理審查任務的委員和工作人員進行相關培訓,使其在出現突發(fā)重大疫情風險時能夠進行高效且有質量的審查工作。
(四) 倫理審查委員會主任委員根據研究的相關專業(yè)領域及其潛在的風險,確定審查成員。
(五)審查成員應當在審查前提供利益沖突申明,保證審查的獨立性與公正性。
(六) 倫理審查委員會應當預先確定專門人員負責出現重大疫情風險時的聯絡工作,應保留所有溝通記錄并存檔。
三、審查方式及要求
( 一)出現突發(fā)重大疫情風險時,開展疫情風險相關醫(yī)學研究的緊迫性對倫理審查委員會的審查工作提出巨大挑戰(zhàn)。倫理審查委員會應當堅持以高科學標準與倫理標準對研究項目進行獨立且公正的審查,保證倫理審查的質量與時效。
(二)審查方式:出現重大疫情風險時,倫理審查委員會可以采用網絡會議及其審查程序,委員應盡可能為應對重大疫情風險相關醫(yī)學研究的審查投入更多的時間和精力。
(三) 倫理審查委員會應預先確定出現重大疫情風險時進行相關
醫(yī)學研究倫理審查的會議審查的人數下限。倫理審查委員會可以預先聯系并及時補充若干名與該研究領域和倫理學領域相關的勝任的專家作為倫理審查委員會的獨立顧問,他們的意見和建議須被完整記錄保存并簽名,必要時可以使用電子簽名。
(四) 倫理審查委員會應制定突發(fā)重大疫情風險時相關醫(yī)學研究需要提交的審查資料清單。研究者提供的資料可以根據情況簡化,但應該至少包括:
1.該項研究與應對突發(fā)重大疫情風險相關性的說明(包括研究的必要性、緊迫性、可行性以及密切相關性);
2.該項研究對該突發(fā)重大疫情風險的可能的前期研究基礎的說明;
3.承擔與開展該項研究的機構和研究組成人員資質的說明,包括是否曾經參與突發(fā)重大疫情風險相關的醫(yī)學研究工作、能否勝任相關研究;
4.研究方案;
5.知情同意書;
6.保護研究參與者個人隱私及保密的措施;
7.對研究參與者可能造成損害的預防措施及賠償方案;8.利益沖突申明。
(五) 為提高審查時效,倫理審查委員會可先接受電子版申請資料(允許隨后補交紙質材料)。
(六) 項目負責人應盡快與倫理審查委員會溝通,說明研究意向、
研究內容與計劃,以便倫理審查委員會知曉研究申請提交意愿并籌備審查工作。
(七)審查時限:倫理審查委員會應當在保證審查質量的前提下盡力縮短審查時間。
對于與突發(fā)重大疫情風險控制密切相關、須緊急開展的醫(yī)學研究,從倫理審查委員會正式受理項目申請(所有申報的材料須真實、全面、有效、符合形式審查要求),至倫理審查委員會作出審查決定的時間,原則上不超過 72 小時。倫理審查委員會在正式受理審查申請后,應立即轉發(fā)給各位委員。收到審查申請材料后,委員應盡快開展審查,并提交審查意見(最遲不超過 48 小時) 。委員會應在收到委員審查意見24 小時之內通過討論形成倫理審查委員會的審查決定,并立即將審查決定傳達給項目負責人。
項目負責人認為有需要時,可以在任何時間與倫理審查委員會就審查決定進行及時溝通。
(八) 在開展研究中,如出現嚴重不良事件等需要進行跟蹤審查時,項目負責人應及時上報給倫理審查委員會。倫理審查委員會應加強對研究項目的跟蹤審查與監(jiān)督管理工作。
(九) 倫理審查委員會負責對所有的審查、溝通等工作做好記錄,并及時進行存檔。
四、審查內容及要求
( 一)即使是在緊急情況下,未經倫理審查委員會事先審查和批準,不允許開展以人作為研究參與者的臨床研究。
(二)突發(fā)重大疫情風險相關醫(yī)學研究應當基于科學和倫理的高標準,尤其在緊急情況下開展的涉及首次應用于人體、具有極大不確定性風險的研究項目,保護研究參與者的安全與權益,確保公眾對科學研究及其科學結果的信任尤為重要。
(三) 應當對機構和研究人員承擔與開展該項醫(yī)學研究的能力進行審查。對于緊急、具有高風險或風險不確定的醫(yī)學研究項目,應當確保其在能夠堅持科學標準、科學價值、臨床實踐標準、倫理標準的機構進行。這些機構和研究人員應當具有設計、開展類似研究的經驗,具有可以利用的設施設備,可以為研究參與者提供安全、高質量的治療與護理,能夠在必要時提供重癥監(jiān)護照護、進行必要的跟蹤隨訪,建立與研究相關的損害賠償機制。
(四) 為應對突發(fā)重大疫情風險開展相關醫(yī)學研究項目雖具有緊迫性,但滿足科學高標準對研究的科學性進行評判是必不可少的,包括但不限于:立項依據;研究與突發(fā)重大疫情風險應對與防控及醫(yī)療救治的相關性;緊急開展的必要性和可行性;開展研究是否會干擾疫情風險應對與防控及醫(yī)療救治;研究設計科學合理性,如樣本量估算、對照組選擇與隨機化分組的合理性、療效指標評價標準的客觀性與合理性;研究結果能否提供明確的有效性和安全性證據等。
對于具有較高風險和/或不確定風險的醫(yī)學研究,應當予以嚴格的科學評判:
1.研究目的旨在獲得研究結果,可以盡快獲得突發(fā)重大疫情風險預防、控制、診斷、治療和康復的有效措施,快速用于疫情應對與疫
情防控及醫(yī)療救治,實現更大的公共衛(wèi)生與醫(yī)療受益;
2.是否無法利用較低風險的研究設計獲得有效的研究結果;
3.研究設計是否有效控制風險,并使研究參與者可能受到的傷害最小化;
4.研究結果可獲得普遍化的知識,可以廣泛并有效地用于應對疫情的干預措施,可以保護與診治更廣泛和/或更高風險感染疫病的人群;為未來的研究提供可靠而有效的數據證據。
(五) 應當對研究參與者選擇標準的合理性進行審查。
1.研究參與者的安全性和潛在風險的可接受性是優(yōu)先考慮的標準;
2.確保研究參與者可能遭受的潛在風險最小化,包括排除因參與研究而處于重大健康風險和損害的人群;
3.避免不合理的納入脆弱人群,包括(但不限于) 社會地位和經 濟地位處于不利狀態(tài)的高風險感染疫病的脆弱人群;可能受到脅迫(包括變相脅迫) 的脆弱人群;因參加研究而承擔較大風險的脆弱人群;
4.研究參與者選擇標準應根據最新的研究結果和新的證據即時更新;
5.為保障應對突發(fā)重大疫情風險的必備資源和能力,在將直接參與應對突發(fā)重大疫情風險的公共衛(wèi)生防疫與醫(yī)療救治人員作為研究參與者時應充分權衡利弊。
(六) 應當特別重視對突發(fā)重大疫情風險相關醫(yī)學研究可能發(fā)生的風險和受益進行評估。
1.研究可能的風險與受益應當與其他可行性的相關研究設計進行比較;
2.研究風險受益比應當合理;
3.在不增加研究參與者風險的前提下,研究設計應當盡可能使受益最大化;
4.研究設計應當實現風險最小化,同時也不為實現風險最小化而損害研究的科學價值;
5.研究風險與受益的評估、風險最小化策略至少應當考慮:研究參與者、社會、研究參與者的接觸者,并盡可能對風險與受益進行量化評估。
(七) 應當特別關注研究的知情同意和知情同意過程。鑒于出現突發(fā)重大疫情風險時的特殊情況,預期的研究參與者可能因明顯的脆弱性而容易遭受不當利用,尤其涉及高風險和具有風險不確定性的醫(yī)學研究項目時,應確保研究參與者在充分知情、完全理解研究可能風險的前提下,自主自愿地選擇參加研究。允許研究參與者或研究參與者監(jiān)護人在任何階段無條件退出研究。
(八) 應當特別關注研究參與者隱私保護措施。
1.應確保研究項目有充分措施以保護研究參與者隱私,維護研究參與者個人信息的保密性;
2.當出于重大公共利益需要使用研究參與者個人信息時,須經有效授權;
3.出現突發(fā)重大疫情風險時,研究參與者可能會轉診到不同的診
療場所。在轉診過程中應當特別注意保護研究參與者隱私,在信息采集、儲存、傳輸和信息使用等方面應當制定并嚴格落實保密措施。
(九) 應特別關注研究中可能存在的利益沖突的識別和管理。
五、研究和審查的團結協(xié)作與監(jiān)督管理
( 一)出現突發(fā)重大疫情風險時,醫(yī)學研究項目決策機構、監(jiān)管機構、研究方、資助方之間應當密切協(xié)作,建立研究協(xié)作機制,鼓勵多中心研究,確保有效的研究參與者樣本量。研究設計應當盡可能標準化,避免開展不必要的重復研究。
(二) 鑒于出現突發(fā)重大疫情風險時醫(yī)療資源和研究資源有限以及有效利用資源的重要意義,應有序開展臨床研究,防止因研究而影響患者治療和整體疫情防控工作。研究者需要自律、嚴謹科學地設計臨床研究,確保研究結果的真實客觀并及時公布,公開申明利益沖突。
(三) 所有突發(fā)重大疫情風險相關的緊急醫(yī)學研究應當在國家醫(yī)學研究登記備案信息系統(tǒng)上傳信息。
(四) 建立研究成果快速共享機制,特別是涉及流行病學研究結果、應對干預措施的安全性與有效性,及可能對研究參與者的傷害等相關信息。
(五) 建立倫理審查協(xié)調協(xié)作機制,接受監(jiān)督和管理。出現突發(fā)重大疫情風險時,多中心研究的牽頭機構在研究現場機構開展的相關醫(yī)學研究,應當建立倫理審查的協(xié)作機制,并進行跟蹤和監(jiān)督。
(六) 建立研究結果及成果發(fā)布監(jiān)管機制,相關研究成果應依法依規(guī)、科學客觀、精準發(fā)布。在媒體發(fā)布研究成果前,應進行同行評
議。研究機構對科研信息發(fā)布負有主體責任。
(七) 嚴格遵守國家關于人類遺傳資源與生物安全的相關要求。凡涉及人類遺傳資源出口或按照國家規(guī)定必須經有關部門審批的內容,均需在項目執(zhí)行前向有關部門申報并獲得批準。涉及傳染病病原微生物研究、檢測、診斷等研究,必須按照國家及地方相關法規(guī)要求進行。加強研究者對個人防護、樣本管理和廢棄物處置等環(huán)節(jié)的審查,確保生物安全。
附則九不同層級、不同機構的倫理委員會溝通要點
一、總則
( 一) 為規(guī)范不同層級、不同機構的倫理委員會之間的溝通、指 導和檢查工作,依據《涉及人的生物醫(yī)學研究倫理審查辦法》、《涉及人的生命科學和醫(yī)學研究倫理審查辦法》、《關于加強科技倫理治理的意見》等制定本溝通要點。
(二) 我國醫(yī)學研究倫理委員會由倫理專家委員會和機構倫理審查委員會組成。倫理專家委員會分為國家醫(yī)學倫理專家委員會和省級醫(yī)學倫理專家委員會,主要負責指導、咨詢和培訓等工作,一般不承擔具體的倫理審查任務。機構倫理審查委員會由醫(yī)療衛(wèi)生機構按相關要求設立,主要負責所在機構倫理審查、培訓和咨詢等工作。
(三)區(qū)域倫理審查委員會與機構倫理審查委員會屬于同等地位,本附則中關于機構倫理審查委員會的內容同樣適用于區(qū)域倫理審查委員會。
(四) 不同層級、不同機構的倫理委員會應當嚴格履行各自職責,開展有效的溝通協(xié)作,堅持倫理審查獨立性、公正性和客觀性,確保所有醫(yī)學研究符合倫理準則和要求,以充分保障研究參與者的安全和權益。
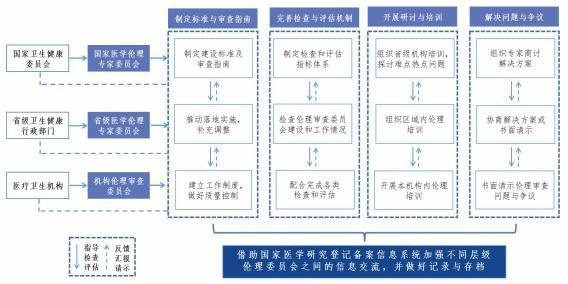
二、不同層級、不同機構的倫理委員會聯動內容和方式
(一) 制定建設標準與審查指南
國家醫(yī)學倫理專家委員會制定機構倫理審查委員會的建設標準和 倫理審查指南,包括審查內容、審查程序、特殊群體的額外保護以及審查時限等;發(fā)布科技倫理高風險活動倫理審查要求;制定倫理審查申請材料的標準要求。
省級醫(yī)學倫理專委員會推動上述倫理審查標準和操作指南在本行政區(qū)域內落地實施,促進區(qū)域內機構倫理審查委員會的建設與運行,規(guī)范倫理審查工作。省級醫(yī)學倫理專家委員會可結合本地區(qū)文化習俗對上述倫理審查標準和操作指南進行補充調整。
機構倫理審查委員會根據國家、省級醫(yī)學倫理專家委員會的指導意見建立并完善倫理審查工作制度、操作規(guī)程,健全利益沖突管理和質量控制機制,確保倫理審查過程獨立、客觀、公正。
(二) 搭建常態(tài)化信息交流平臺
不同層級、不同機構的倫理委員會要充分利用國家醫(yī)學研究登記備案信息系統(tǒng)做好備案工作,備案內容包括倫理委員會工作制度和規(guī)程、辦公室聯系方式(郵箱、工作電話等)、委員基本信息及常用聯系方式(郵箱、工作電話等) 等。機構倫理審查委員會應及時將研究項 目的倫理審查意見(包括初始審查、各類跟蹤審查等)、年度工作報告等信息按要求如實、完整、準確上傳,并根據研究進展及時更新信息。國家、省級醫(yī)學倫理專家委員會可在系統(tǒng)中查閱相關備案信息。
不同層級、不同機構的倫理委員會可根據實際需要利用多種交流渠道,如內部郵件、電話、網絡會議等,加強信息溝通交流,及時、有效地解決倫理審查工作中的相關問題。針對重大醫(yī)學研究項目,不
同層級、不同機構的倫理委員會可根據監(jiān)管職責在國家醫(yī)學研究登記 備案信息系統(tǒng)中發(fā)布倫理審查要點,建立倫理審查協(xié)作機制,確保遵循一致性原則。
(三)完善檢查與評估機制
國家醫(yī)學倫理專家委員會制定機構倫理審查委員會檢查與評估指 標體系,包括審查質量、審查效率、委員能力、利益沖突管理等內容,指導省級醫(yī)學倫理專家委員會開展區(qū)域內的倫理檢查工作;對省級醫(yī)學倫理專家委員會的工作進行檢查、評估和督導。
省級醫(yī)學倫理專家委員會負責對本級行政區(qū)域內醫(yī)療機構及區(qū)域倫理委員會的倫理審查工作情況進行定期檢查和評估,對不規(guī)范的倫理審查工作提出處理建議,并可根據實際情況建立信息公開機制。
機構倫理審查委員會應對照檢查與評估指標體系,不斷完善自身建設,積極配合完成各類檢查評估。鼓勵開展定期自評,提升工作質量和審查效率
(四)開展研討與培訓
倫理專家委員會針對倫理審查中的熱點、難點問題,可邀請專業(yè)人士進行深入解析和探討,并積極參與國內外學術研討,舉辦全國和區(qū)域性研討會,推動我國倫理審查、管理制度進一步完善,促使我國倫理審查制度建設的國際交流與對話。
不同層級、不同機構的倫理委員會定期開展倫理培訓。國家醫(yī)學倫理專家委員會負責組織面向省級相關機構的培訓。省級醫(yī)學倫理專家委員會負責組織本行政區(qū)域內醫(yī)療衛(wèi)生機構的倫理培訓,可邀請國
家醫(yī)學倫理專家委員擔任培訓專家。機構倫理審查委員會負責開展針對本機構倫理委員、研究者、科研管理人員等相關人員的倫理知識培訓。培訓可采用線上線下多種方式開展,包括培訓講座、專題研討會、案例分析、角色扮演等,鼓勵跨領域倫理審查與管理的交流。
(五)解決問題與爭議
不同層級、不同機構的倫理委員會之間應加強溝通交流,確保倫理審查標準及其結論的合理性。對存在爭議的倫理問題,可采取集體討論、咨詢上級倫理專家委員會等方式,尋求解決辦法。
當研究的倫理審查存在重大爭議時,研究牽頭單位的倫理審查委員會可以向其所在省份的醫(yī)學倫理專家委員會尋求解決方案;如省級醫(yī)學倫理專家委員會認為有必要可以請國家醫(yī)學倫理專家委員會給予指導。國家、省級醫(yī)學倫理專家委員會可以以合適的方式組織委員、專家討論,提出建議。
(六)做好記錄與存檔
對于不同層級、不同機構的倫理委員會之間開展的培訓、交流和檢查等相關工作,應如實做好各自的工作記錄并采取合適的方式進行存檔。對于重大倫理事項,要做好書面或者電子材料存檔工作,以備后期檢查。
倫理委員會層級聯動流程圖


用戶登錄
還沒有賬號?
立即注冊